
| 金属(粉末状) | 酸的浓度 | |
| A | Mg | 6 mol/L硝酸 |
| B | Zn | 3 mol/L硫酸 |
| C | Fe | 6 mol/L盐酸 |
| D | Cu | 6 mol/L硫酸 |
| A. | A | B. | B | C. | C | D. | D |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
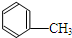
| A. | 甲苯与氢气可以发生加成反应 | B. | 甲苯燃烧带有浓厚的黑烟 | ||
| C. | 甲苯能使酸性高锰酸钾溶液褪色 | D. | 甲苯硝化生成三硝基甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60s时X的平均反应速率为0.02mol/L | |
| B. | 将容器容积变为20L,Z的新平衡浓度将等于原平衡浓度的$\frac{1}{2}$ | |
| C. | 若温度和体积不变,往容器内增加1molX,Y的转化率将增大 | |
| D. | 若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价为+7 | B. | Cl2中含有极性共价键 | ||
| C. | HClO4比H2SO4酸性弱 | D. | Cl是卤素中原子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
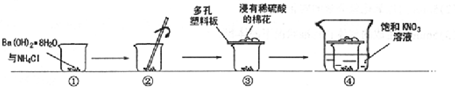
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C:CH3CH2OH
C:CH3CH2OH .
. +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | B. | 氧化性:Na+>K+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 酸性:HF>HCl>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫用作食品防腐剂 | |
| B. | 明矾用于水的净化 | |
| C. | 盛放氢氧化钠溶液时,使用带橡皮塞的磨口瓶 | |
| D. | 在常温下用铝制贮罐贮运浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com