
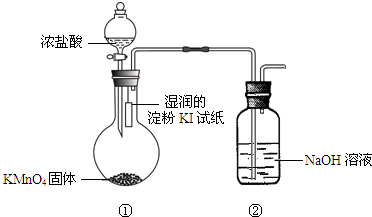
 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列仪器在使用前必须检查其是否漏水的是
(1)下列仪器在使用前必须检查其是否漏水的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ba2+、NO3-、Cl- |
| B、Cl-、SO42-、Na+、K+ |
| C、SO42-、NO3-、Fe2+、Mg2+ |
| D、Na+、K+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤⑥ | B、①③⑥ |
| C、②④⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液中:c(HB)+c(B-)=0.05mol/L |
| B、混合溶液中:c(OH-)+c(B-)-c(H+)=0.04mol/L |
| C、该NaB溶液中:c(H+)+c(HB)=1.0×10-6mol/L |
| D、该NaB溶液中:c(Na+)-c(B-)=9.9×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2 |
| B、NO |
| C、N2O |
| D、NH4NO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com