
【题目】某小组用如图装置进行实验,下列说法正确的是( ) 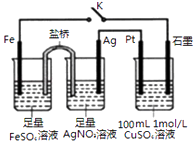
A.盐桥中的电解质可以用KC1
B.闭合K,石墨电极上只生成铜
C.当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023
D.导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3 , CuSO4溶液可恢复原组成
【答案】D
【解析】 解:A.由于KCl能和AgNO3产生沉淀,因此盐桥中的电解质不能用KCl,故A错误;
B.闭合K,与铁相连的石墨为阴极,发生还原反应首先Cu2++2e﹣═Cu,析出Cu,后发生2H++2e﹣═H2 , 放出氢气,故B错误;
C.0.1mol铁失去0.2mol电子,但电子不能通过溶液传递,而是经过导线,故C错误;
D.CuSO4溶液中n(Cu2+)=0.1mol,完全消耗时转移电子数为0.2mol,导线中流过03mol e﹣说明水也参与了电解,电解CuSO4的总反应2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.1molCuO,电解水的总反应2H2O
2Cu+O2↑+4H+ , 溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.1molCuO,电解水的总反应2H2O ![]() 2H2↑+O2↑,转移电子数为0.1mol,因此消耗0.05mol的H2O,Cu2(OH)2CO3可写为2CuOH2OCO2 , 所以加入0.05mol×222g/mol=11.1g Cu2(OH)2CO3 , CuSO4溶液可恢复原组成,故D正确;
2H2↑+O2↑,转移电子数为0.1mol,因此消耗0.05mol的H2O,Cu2(OH)2CO3可写为2CuOH2OCO2 , 所以加入0.05mol×222g/mol=11.1g Cu2(OH)2CO3 , CuSO4溶液可恢复原组成,故D正确;
故选D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂.
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有性.
(2)①在100mL 18molL﹣1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44L,则参加反应的铜片的质量为(选填序号);
a.115.2g b.76.8g c.57.6g d.38.4g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: .
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol
B.1 mol
C.1.05 mol
D.0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定大量共存的是( )
A.使甲基橙呈红色的溶液中:Na+、AlO2﹣、NO3﹣、CO32﹣
B.c(ClO﹣)=1.0 mol?L﹣1溶液:Na+、SO32﹣、S2﹣、Cl﹣
C.含有0.1 mol?L﹣1 HCO3﹣的溶液:Na+、Fe3+、NO ![]() 、C6H5O﹣
、C6H5O﹣
D.![]() =0.1 mol?L﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
=0.1 mol?L﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类使用金属材料历史悠久。下列说法不正确的是
A. 电解NaCl溶液制备NaB. 电解熔融MgCl2制备Mg
C. 钢体船外镇嵌锌板可起防腐作用D. 青铜器的材质属于含锡合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下浓硫酸能将木炭粉氧化成CO2 , 本身被还原成SO2。试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
(1)这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):→→→。
(2)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用是 , B瓶溶液的作用是 , C瓶溶液的作用是。写出B中发生的离子方程式。
(3)装置②中所加的固体药品是 , 可验证的产物是。
(4)装置③中所盛溶液是 , 可验证的产物是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液里,只含有下列八种离子中的某几种:Mg2+、Na+、H+、Ag+、Cl﹣、 ![]() .已知该溶液能跟金属铝反应,且放出的气体只有氢气,试回答:
.已知该溶液能跟金属铝反应,且放出的气体只有氢气,试回答:
(1)若溶液跟Al反应后有[Al(OH)4]﹣生成,则原溶液一定含有大量的离子,还可能含有大量的离子.
(2)若溶液跟Al反应后有Al3+生成,则原溶液中一定不含有大量离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-===2AlO![]() +H2↑
+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
C. 三氯化铁溶液中加入铁粉:Fe3++Fe===2Fe2+
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下列步骤配制100mL0.200molL﹣1Na2CO3溶液,请回答有关问题.
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为 . |
(2)称量Na2CO3固体 | 称量过程中应用到的主要仪器是 . |
(3)将Na2CO3加入100mL烧杯中,加入适量蒸馏水 | 为了加快溶解速率,常采取的措施是 . |
(4)将烧杯中的溶液转移至仪器A(已检查不漏水)中 | ①在转移Na2CO3溶液前应将溶液 ; |
(5)向仪器A中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 . |
(6)摇匀、装瓶,操作B,最后清洁、整理 | 操作B是 . |
讨论按上述步骤配制的Na2CO3溶液的浓度 (选填“是”或“不是”)0.200molL﹣1 . 理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com