
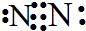 .
.分析 原子序数依次增大的A、B、C、D四种元素,C元素最外层电子数是内层的3倍,最外层最多含有8个电子,则C只能含有2个电子层,最外层含有6个电子,其原子序数为8,故C为O元素;D是常见金属元素,其单质与强碱溶液反应可生成A的单质,该单质为氢气,则D为Al元素,A为H元素;B元素的p轨道电子数比s轨道电子数少1,B的原子序数小于C(O元素),则B含有2个电子层,s轨道的总电子数为4,p轨道的总电子数为3,B原子核外电子排布为1s22s22p3,故B的原子序数为7,是N元素,据此进行解答.
解答 解:C元素最外层电子数是内层的3倍,最外层最多含有8个电子,则C只能含有2个电子层,最外层含有6个电子,其原子序数为8,故C为O元素;D是常见金属元素,其单质与强碱溶液反应可生成A的单质,该单质为氢气,则D为Al元素,A为H元素;B元素的p轨道电子数比s轨道电子数少1,B的原子序数小于C(O元素),则B含有2个电子层,s轨道的总电子数为4,p轨道的总电子数为3,B原子核外电子排布为1s22s22p3,故B的原子序数为7,是N元素,
(1)D为Al元素,Al元素基态原子最外层含有3个电子,其价电子排布式为3s23p1,
故答案为:3s23p1;
(2)A、C形成的3原子分子X为水分子,A、B形成的4原子分子Y氨气,根据杂化轨道理论可知NH3分子中N原子和H2O中的O原子均是按sp3杂化,但氨分子中只有一对孤电子对,而水分子中有两对孤电子对,根据价层电子对互斥理论,水中氧原子中的了两对孤电子对对成键电子的斥力更大,所以NH3分子中键角大于H2O中的键角;
由于水分子之间含有氢键,水凝固成冰时,水分子排列有序化,形成的氢键数目增多,体积膨胀;
乙醛分子之间存在氢键,乙醛中氧元素与水分子的H原子、水的O原子与乙醛的H、水与水之间形成的氢键,所以总共含有4种氢键,
故答案为:NH3分子中N原子和H2O中的O原子均是按sp3杂化,N原子有一对孤对电子,而O原子有两对孤对电子,对成键电子的斥力更大,使键角更小;水分子之间含有氢键,水凝固成冰时,水分子排列有序化,体积膨胀,形成的氢键数目增多;4;
(3)由于N原子的2p轨道处于半满状态,比较稳定,则第一电离能较大,则第一电离能大小为;B<C;同周期元素从左到右,电负性逐渐增强,电负性大小:B<C,
故答案为:<;<;
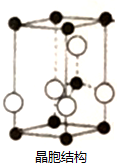
(4)在一定条件下C、D的化合物为氧化铝,B单质为氮气,炭单质反应生成M和还原性可燃气体N为CO,M是B、D形成的晶体,熔点较高,根据晶胞结构图可知,Al和N原子数之比为1:1,则M为AlN,生成AlN的化学方程式为:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;单质Q是N的等电子体,N为CO,含有2个原子、14个电子,组成Q的原子含有的电子数为:$\frac{14}{2}$=7,故Q为氮气,氮气分子中含有氮氮三键,则氮气的电子式为: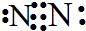 ,
,
故答案为:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO;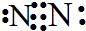 ;
;
(5)上述AlN晶体中所含化学键共价键和配位键,晶胞中深色黑点为N原子,N原子形成3个σ键键和1个配位键,其杂化方式为sp3杂化;
若晶胞体积为Vcm3,晶体密度为ρg•cm3,每个晶胞的质量为:m=ρg•cm3×Vcm3=ρVg,每个晶胞中含有N原子数为:8×$\frac{1}{8}$+1=2,则该晶胞中含有两个AlN分子,故每个晶胞的质量为:$\frac{41}{{N}_{A}}$g×2=ρVg,解得:NA=$\frac{81}{ρV}$,
故答案为:共价键、配位键;sp3;=$\frac{81}{ρV}$.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断各元素名称为解答关键,注意熟练掌握常见元素的原子结构与元素周期表、元素周期律的关系,(5)为难点,需要掌握晶胞计算的方法与技巧.


科目:高中化学 来源: 题型:填空题
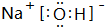 ;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T.
;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
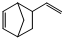 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体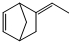 .
. 由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是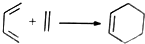 .
.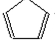 .
.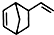 互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.
互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
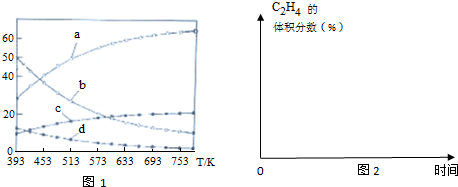
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,c(H2PO4-)增大 | |
| B. | 加水稀释后,m(H+)与m(OH-)的乘积减少 | |
| C. | c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-) | |
| D. | c(Na+)=c(H2PO4-)+c(HPO42-)+C(H3PO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
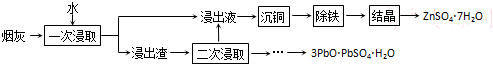
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
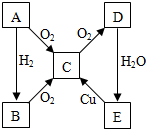 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com