
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
��1����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)  CO(g)��H2(g) ��H����131.3 kJ��mol��1 һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
CO(g)��H2(g) ��H����131.3 kJ��mol��1 һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
A�������е�ѹǿ����
B��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
C��v��(CO)��v��(H2O)
D��c(CO)��c(H2)
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
ʵ �� �� | �� �� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
�ٸ÷�Ӧ���淴ӦΪ (������š�)�ȷ�Ӧ��
����ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����a��bӦ����Ĺ�ϵ�� (�ú�a��b����ѧʽ��ʾ)��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)+3H2(g)  CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
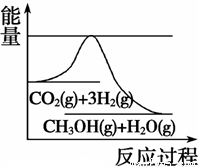
A�������¶�
B������N2(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з������
D���ٳ���0.5 mol CO2��1.5 mol H2
(1)B��C (2) �� ���ȣ� �� b=2a����a>1 (3)C��D
��������
���������(1)���ڷ�ӦC(s)��H2O(g)  CO(g)��H2(g)������Ӧ�Ǹ������������ķ�Ӧ��A������Ӧδ�ﵽƽ�⣬�������е�ѹǿ�ᷢ���ı䣬����Ӧ�ﵽ��ƽ�⣬�������������ѹǿ���䡣��ȷ��B��1 mol H��H�����Ѿͻ����1mol��ˮ�����γ���2mol��H��O������ͬʱ����2 mol H��O����˵������ͬ��������˵����λʱ�������������������ȡ���Ӧ�ﵽƽ�⡣��ȷ��D��CO��H2����������ڷ���ʽ�ж��ߵ�ϵ����ͬ���������κ�ʱ����c(CO)��c(H2)���ʲ���ȷ����Ӧ�ﵽƽ�⡣��������ѡ��ΪB C����2���� ��ӦCO(g)��H2O(g)
CO(g)��H2(g)������Ӧ�Ǹ������������ķ�Ӧ��A������Ӧδ�ﵽƽ�⣬�������е�ѹǿ�ᷢ���ı䣬����Ӧ�ﵽ��ƽ�⣬�������������ѹǿ���䡣��ȷ��B��1 mol H��H�����Ѿͻ����1mol��ˮ�����γ���2mol��H��O������ͬʱ����2 mol H��O����˵������ͬ��������˵����λʱ�������������������ȡ���Ӧ�ﵽƽ�⡣��ȷ��D��CO��H2����������ڷ���ʽ�ж��ߵ�ϵ����ͬ���������κ�ʱ����c(CO)��c(H2)���ʲ���ȷ����Ӧ�ﵽƽ�⡣��������ѡ��ΪB C����2���� ��ӦCO(g)��H2O(g)  CO2(g)��H2(g)��650��ʱ����ʼʱn(CO)=4mol��n(H2O)=2mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)=4mol��1.6mol=2.4mol��n(H2O)=2mol��1.6mol=0.4mol,n(CO2)=1.6mol��n(H2)=1.6mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��ƽ�ⳣ��Ϊ
CO2(g)��H2(g)��650��ʱ����ʼʱn(CO)=4mol��n(H2O)=2mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)=4mol��1.6mol=2.4mol��n(H2O)=2mol��1.6mol=0.4mol,n(CO2)=1.6mol��n(H2)=1.6mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��ƽ�ⳣ��Ϊ ����900��ʱ����ʼʱn(CO)=2mol��n(H2O)=1mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)= 1.6mol��n(H2O)=1mol��0.4mol=0.6mol,n(CO2)=0.4mol��n(H2)=0.4mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��Ũ�ȱ�Ϊ���ʵ����ıȡ������ڸ��¶���ƽ�ⳣ��Ϊ
����900��ʱ����ʼʱn(CO)=2mol��n(H2O)=1mol��n(CO2)=0��n(H2)=0.����Ӧ�ﵽƽ��ʱ�������ʵ����ʵ���Ϊn(CO)= 1.6mol��n(H2O)=1mol��0.4mol=0.6mol,n(CO2)=0.4mol��n(H2)=0.4mol�����ڸ÷�Ӧ��˵������ϵ������1�����Դﵽƽ��״̬ʱ��Ũ�ȱ�Ϊ���ʵ����ıȡ������ڸ��¶���ƽ�ⳣ��Ϊ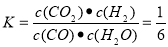 �������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ������ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����Ϊ��Ӧ��ƽ��״̬��ͬ��������ʽ��ϵ����ͬ������ֻҪ��Ӧ������ʵ����ı���ԭƽ�����ʼʱ�����ʵ����ı���ͬ�������ߵ����ʵ����ı�Ϊa:b=1:2��ƽ�ⲻ�����ƶ���������������ѹǿ����Ӧ������ʵ���Ũ������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ˮ�����̡�(3)��ͼ����Կ����÷�ӦΪ���ȷ�Ӧ��A�������¶ȡ�����ƽ���ƶ�ԭ������ѧƽ�����淴Ӧ�����ƶ���c(CH3OH)��С������B������N2���Ƿ�Ӧ��ϵ�����壬����N2(g)��ʹ��ϵѹǿ�����Ƿ�Ӧ������и����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ���c(CH3OH)���䡣����C. ��H2O(g)����ϵ�з������,��С�������Ũ�ȣ�ƽ�������ƶ���c(CH3OH)������ȷ��D�����ٳ���0.5 mol CO2��1.5 mol H2������Ӧ���Ũ�ȣ���ѧƽ�������ƶ���c(CH3OH)������ȷ��
�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ������ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����Ϊ��Ӧ��ƽ��״̬��ͬ��������ʽ��ϵ����ͬ������ֻҪ��Ӧ������ʵ����ı���ԭƽ�����ʼʱ�����ʵ����ı���ͬ�������ߵ����ʵ����ı�Ϊa:b=1:2��ƽ�ⲻ�����ƶ���������������ѹǿ����Ӧ������ʵ���Ũ������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ˮ�����̡�(3)��ͼ����Կ����÷�ӦΪ���ȷ�Ӧ��A�������¶ȡ�����ƽ���ƶ�ԭ������ѧƽ�����淴Ӧ�����ƶ���c(CH3OH)��С������B������N2���Ƿ�Ӧ��ϵ�����壬����N2(g)��ʹ��ϵѹǿ�����Ƿ�Ӧ������и����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ���c(CH3OH)���䡣����C. ��H2O(g)����ϵ�з������,��С�������Ũ�ȣ�ƽ�������ƶ���c(CH3OH)������ȷ��D�����ٳ���0.5 mol CO2��1.5 mol H2������Ӧ���Ũ�ȣ���ѧƽ�������ƶ���c(CH3OH)������ȷ��
���㣺���黯ѧƽ��״̬���жϡ���Ӧ�ȵļ��㼰��������Ի�ѧƽ���ƶ���Ӱ���֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡͬ����ʱ�����˽�ѡ��4��1.2 ȼ������Դ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�еķ�Ӧ���»��ߴ���ʾȼ���ȵ���(����)
A��NH3(g)+O2(g) NO(g)+H2O(g)����H=-a kJ��mol-1
NO(g)+H2O(g)����H=-a kJ��mol-1
B��C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)����H=-b kJ��mol-1
6CO2(g)+6H2O(l)����H=-b kJ��mol-1
C��2CO(g)+O2(g) 2CO2(g)����H=-c kJ��mol-1
2CO2(g)����H=-c kJ��mol-1
D��CH3CH2OH(l)+O2(g) CH3CHO(l)+H2O(l)����H=-d kJ��mol-1
CH3CHO(l)+H2O(l)����H=-d kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��������ѧͬ����ʱ�����˽�ѡ��4��2.3��ѧƽ���ƶ��Ծ��������棩 ���ͣ�ѡ����
��Ӧ2X(g)+Y(g) 2Z(g)+Q���ڲ�ͬ�¶�(T1��T2)��ѹǿ(p1��p2)�£�����Z�����ʵ���n�뷴Ӧʱ��t�Ĺ�ϵ����ͼ��ʾ�������ж���ȷ����(����)
2Z(g)+Q���ڲ�ͬ�¶�(T1��T2)��ѹǿ(p1��p2)�£�����Z�����ʵ���n�뷴Ӧʱ��t�Ĺ�ϵ����ͼ��ʾ�������ж���ȷ����(����)
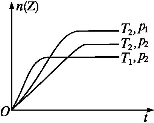
A��T1<T2��p1<p2B��T1<T2��p1>p2 C��T1>T2��p1>p2D��T1>T2��p1<p2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��������ѧͬ����ʱ�����˽�ѡ��4��2.1 ��ѧ��Ӧ�����Ծ��������棩 ���ͣ�ѡ����
ijһ��Ӧ���Ũ����2.0 mol��L-1������4 min������Ũ�ȱ��1.68 mol��L-1��������4 min������ƽ����Ӧ����Ϊ(����)
A��0.2 mol��L-1��min-1
B��0.1 mol��L-1��min-1
C��0.04 mol��L-1��min-1
D��0.08 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��������ѧͬ����ʱ�����˽�ѡ��4��1.3��ѧ��Ӧ�ȵļ��㣨�����棩 ���ͣ�ѡ����
���ݵ���������Ӧ���Ȼ�ѧ����ʽ
��1��I2(g)+H2(g)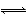 2HI(g)����H=-9��48 kJ
2HI(g)����H=-9��48 kJ
��2��I2(s)+H2(g)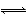 2HI(g)����H=26��48 kJ
2HI(g)����H=26��48 kJ
�����ж���ȷ����(����)
A��254 g I2(g)��ͨ��2 g H2(g)����Ӧ����9��48 kJ
B��1 mol��̬����1 mol��̬���������������17��00 kJ
C����Ӧ��1���IJ���ȷ�Ӧ��2���IJ����ȶ�
D����Ӧ��2���ķ�Ӧ���������ȷ�Ӧ��1���ķ�Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ�ѡ����
���淴ӦaA��g����bB��g�� cC��g����dD��g����Hͬʱ����������ͼ�и����ߵĹ��ɵ�( )
cC��g����dD��g����Hͬʱ����������ͼ�и����ߵĹ��ɵ�( )

A��a��b��c��d T1��T2 ��H��0
B��a��b��c��d T1��T2 ��H��0
C��a��b��c��d T1��T2 ��H��0
D��a��b��c��d T1��T2 ��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ�ѡ����
T ��ʱ��2 L�ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z�����ʵ����仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Y�İٷֺ�����ʱ��Ĺ�ϵ��ͼ2��ʾ�������н�����ȷ����( )
A����Ӧ���е�ǰ3 min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.3 mol��L��1��min��1
B�������з����ķ�Ӧ�ɱ�ʾΪ��3X(g)��Y(g) = 2Z(g)
C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K����
D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�ڵ�һ���¿������Ծ��������棩 ���ͣ�ѡ����
����װ��Ӧ����ʵ�����������������Ȼ��̵�ʵ�飬�ܴﵽʵ��Ŀ�ĵ���

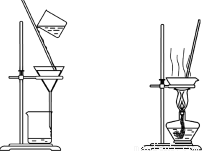
�ס������������������ҡ� ����������������������
A����װ�ü���ȡ����
B����װ���ҳ�ȥ�����е������Ȼ���
C����װ�ñ�����������̺��Ȼ�����Һ
D����װ�ö������Ȼ�����Һ��MnCl2��4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ��и���������9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���仯�У�ǰ���������仯�������ǻ�ѧ�仯����
A��ú��������ú�ĸ���
B�������������������⡢ʳ��ˮ����
C����ɫ��Ӧ��ʯ�͵��ѻ�
D���ȵı���KNO3��Һ�����������塢����̼ϴ���Թ��ڱ��ϵ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com