
分析 电解质是:在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是:在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
单质和混合物既不是电解质也不是非电解质.
解答 解:①Cl2是单质,既不是电解质也不是非电解质;
②Na2O 是化合物,熔融状态下能够导电,是电解质;
③BaSO4是化合物,熔融状态下能够导电,是电解质;
④NaCl溶液是混合物,既不是电解质也不是非电解质;
⑤CO2是化合物,本身不能电离电离出自由离子而导电,属于非电解质;
⑥NH3是化合物,本身不能电离电离出自由离子而导电,属于非电解质;
⑦CH3CH2OH是化合物,在水溶液里和熔融状态下都不能导电,属于非电解质;
⑧NaOH是化合物,水溶液或者熔融状态下能够导电,是电解质;
⑨H2O 是化合物,水溶液能导电,属于电解质;
⑩HCl,是化合物,在水溶液里能导电,属于电解质;
所以:属于电解质的是②③⑧⑨⑩,属于非电解质的是⑤⑥⑦;
故答案为:②③⑧⑨⑩;⑤⑥⑦;
点评 本题考查了电解质、非电解质的判断,明确电解质、非电解质的定义是解题关键,注意单质和混合物既不是电解质也不是非电解质,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 含MnO2的分散系中,K+、H2O2、S、Br--可以大量共存 | |
| B. | MnO2和浓盐酸反应的离子方程式:4HCl+MnO2═2Cl-+Cl2↑+Mn2++2H2O | |
| C. | MnO2在高锰酸钾的分解反应中是氧化产物 | |
| D. | 1 mol MnO2和参与反应:3MnO2+4Al═3Mn+2Al2O3,转移4 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
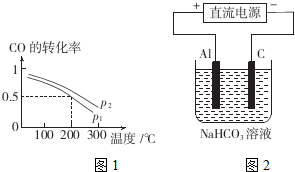
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
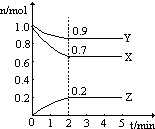 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L 0.5mol/LNa2S溶液中含有的S2-个数为NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
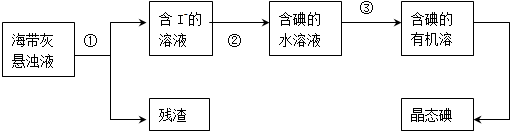
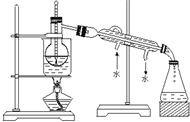
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯与浓硝酸、浓硫酸的混合物在100℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾溶液即可检验CH2═CH-CHO中的碳碳双键 | |
| C. | 将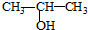 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com