
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |
分析 A.熵增代表混乱度增大,从化学方程式分析混乱度的变化,熵增的反应大多具有自发性;
B.熵是指体系的混乱度,同物质气体熵大于液体大于固体;
C.自发过程体系的熵变不一定小于零;
D.改变条件后,自发进行的反应也能够发生.
解答 解:A.碳酸铵固体分解生成了二氧化碳、氨气和水,体系的混乱度增大,即熵增大,熵增的反应大多具有自发性,故A正确;
B.熵是指体系的混乱度,同物质气体熵大于液体大于固体;同种物质气态时熵值最大,固态时熵值最小,故B正确;
C.只有△H-T△S<0,反应能自发进行,与外界隔离的体系,自发过程将导致体系的熵可能增大,也可能减小,故C错误;
D.自发进行只能说明反应进行的方向,不能说明反应发生的难易和快慢,有些非自发进行的反应在一定条件下也可以发生,故D正确;
故选C.
点评 本题考查反应热与焓变的应用,题目难度中等,注意物质的熵的含义理解,明确反应自发进行的判断依据,掌握基础是解题关键,试题培养了学生的灵活应用能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
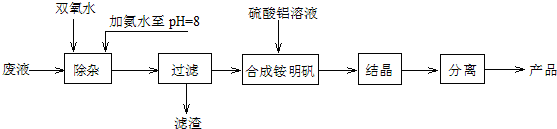
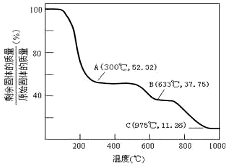
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 30% | D. | 70% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
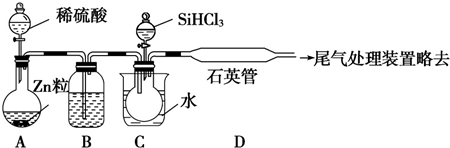
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com