

分析 向孔雀石中加入试剂①为稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,铁的氧化物溶于稀硫酸生成铁盐、亚铁盐和水,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,同时生成CO2,向溶液A中加入试剂②得到溶液B,试剂②是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,应该选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和Fe(OH)3,过滤得到溶液C为硫酸铜溶液,经蒸发结晶可得到胆矾,以此解答该题.
解答 解:(1)试剂①是一种常见的酸,应为硫酸,最终得到硫酸铜,以避免引入新杂质,过滤所需要的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:H2SO4;漏斗、烧杯、玻璃棒;
(2)检验铁离子,可取样,向其中滴加KSCN溶液,溶液变血红色,则含有Fe3+,故答案为:取样,向其中滴加KSCN溶液,溶液变血红色,则含有Fe3+;
(3)不用加入氯水,否则生成氯化铜而引入新杂质,故答案为:不能,如加氯水会引入杂质Cl-;
(4)由溶液C获得胆矾,需要经过蒸发浓缩、冷却结晶、过滤等操作,故答案为:蒸发浓缩;冷却结晶;
(5)n(KMnO4)=1.000×10-2mol/L×0.02L=2.000×10-4mol,离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,可知n(Fe2+)=1.000×10-3mol,
则溶液A中Fe2+的浓度为$\frac{0.001mol}{0.025L}$=0.040mol/L,
故答案为:0.040mol/L.
点评 本题考查物质制备及物质分离和提纯,为高考高频点,侧重考查学生分析、计算及实验操作能力,关键是明确实验原理及基本操作方法,知道流程图中发生的反应及操作方法,难点是(5)的计算,注意把握化学方程式的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列关于试剂存放的叙述正确的是

A. 浓硫酸的装运包装箱应贴上如图所示的标识
B. 金属钠保存在CCl4中(钠的密度小于CCl4)
C. 氢氧化钠溶液保存在带玻璃塞的玻璃瓶中
D. 硝酸银溶液存放在无色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点/℃ | 溶解性 | 与饱和NaHSO3溶液混合 | |
| A | 75.7 | 微溶于水 | 发生化合反应,生成沉淀 |
| B | 118 | 溶于水 | 不反应 |
| C | 34 | 微溶于水,与B互溶 | 不反应 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用药品 | 实验现象 | 利用NaNO2的性质 |
| ①酚酞试液 | 溶液变红 | 溶液显碱性 |
| ②淀粉-KI试纸 | 试纸变蓝 | 氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
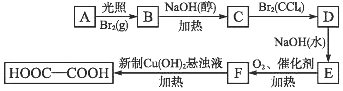
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 6.6 | 5.2 | 4.4 |
| 沉淀完全时的pH | 3.7 | 8.9 | 8.1 | 5.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com