
科目:高中化学 来源: 题型:
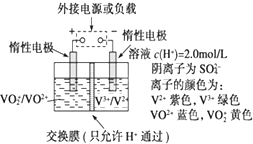 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25mol |
| B、0.2mol |
| C、0.15mol |
| D、0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol |
| B、0.3mol |
| C、0.5mol |
| D、0.45mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、ω(
| ||
D、ω(
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,VL辛烷所含分子数为
| ||
| B、1.5 mol NO2与足量H2O反应,转移的电子数为nA | ||
| C、常温常压下,0.2mol的SiO2所含分子数为0.2NA | ||
D、31g白磷(P4)中含有
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3溶于水是自发过程 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时最小 |
| C、借助于外力能自发进行的过程,其体系的能量趋向于从高能状态转变为低能状态 |
| D、由能量判据(以焓变为基础)和熵判据组合而成的复合判据,更适合于所有的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol?L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol?L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com