
分析 结合M=$\frac{m}{n}$、n=$\frac{V}{Vm}$及分子构成计算.
解答 解:n(H2X)=$\frac{11.2L}{22.4L/mol}$=0.5mol,M(H2X)=$\frac{17g}{0.5mol}$=34g/mol,可知X的相对原子质量为34-1×2=32;等物质的量的NH3与H2S中氢原子数目比为n×3:n×2=3:2,由$\frac{1.7g}{17g/mol}$×3=n×2,可知n=0.15,即1.7g氨气与0.15mol H2O含有的氢原子数相等,
故答案为:32;3:2;0.15.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意分子构成的判断,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
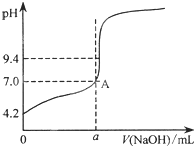 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
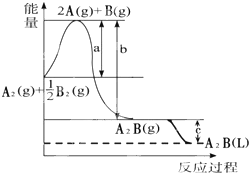 已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:
已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,饱和溶液一定比不饱和溶液导电性强 | |
| B. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| C. | 晶体NaCl不导电,所以它不是电解质,而铜、铁等金属能导电,所以它们是电解质 | |
| D. | 氯化氢溶于水能导电,但液态氯化氢不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
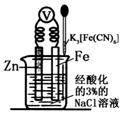
| A. | 该装置为电解池 | |
| B. | 本实验牺牲了金属Fe来保护金属Zn | |
| C. | 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀 | |
| D. | 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com