
【题目】在下列事实中,各是什么因素影响了化学反应的速率。
(1)黄铁矿煅烧时要粉碎成细小颗粒______________;
(2)夏天的食品变霉,在冬天不易发生该现象_____________;
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同__;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同_____________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体__________;
(6)如下图,铁在海水中的腐蚀速度是②比①快______。

【答案】固体表面积 温度 反应物自身的性质 浓度 催化剂 形成原电池并作负极
【解析】
根据外界条件对反应速率的影响变化规律分析解答。
(1). 黄铁矿煅烧时要粉碎成细小颗粒,固体表面积增大,反应速率增大,
故答案为:固体表面积;
(2).冬天温度较低,温度越低,反应速率越小,
故答案为:温度;
(3). 镁比锌活泼,与酸反应更剧烈,说明物质的本身性质是影响反应速率的主要因素,
故答案为:反应物本身性质;
(4). 盐酸的浓度不同,反应速率不同,浓度越大,反应速率越大,
故答案为:浓度;
(5). MnO2为KClO3分解的催化剂,加入催化剂,可增大反应速率,
故答案为:催化剂;
(6). 铁在海水中发生的是吸氧腐蚀,铁锡一同在海水中,铁比锡活泼,做原电池的负极,发生的是原电池反应,会加快铁的腐蚀速率。
故答案为:形成原电池并作负极。


科目:高中化学 来源: 题型:
【题目】已知在25℃时,AgCl的Ksp为1.8×10-10,Ag2S的Ksp为6.3×10-50,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A. 只有Ag2S沉淀生成 B. AgCl和Ag2S等物质的量生成
C. AgCl沉淀多于Ag2S沉淀 D. Ag2S沉淀多于AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力。下面是从海带中提取碘单质的流程:
海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 含I-的溶液
含I-的溶液![]() 含I2的溶液
含I2的溶液![]() 含I2的四氯化碳溶液
含I2的四氯化碳溶液![]() 晶体碘
晶体碘
(1)在上述流程中,属于过滤操作的是___(用a、b、c、d表示,下同),属于萃取操作的是___。
(2)现有烧杯、玻璃棒和必需的夹持仪器,完成过滤操作尚缺少的玻璃仪器是___,完成萃取操作还需要的玻璃仪器是___。
(3)写出含I-的溶液中通氯气后发生反应的离子方程式:___。
(4)含I2的水溶液中加入四氯化碳,振荡后静置,观察到溶液分层,下层溶液显___。
(5)四氯化碳能从碘水中萃取出碘的原因是①___,②___,③___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5。其液体状态呈红褐色。遇水易水解,伴随有氯伴随有氯化氢生成。某化学兴趣小组按下图装置用Cl2和NO制备NOC1。回答下列相关问题:

(1)仪器a的名称是_____,装置甲中反应的离子方程式是______.
(2)装置乙的作用是____,实验开始时,先打开活塞k,当观察到装置丙中出现____(填现象)时再缓缓通入Cl2.
(3)装置丙中生成NOC1的反应方程式是___,装置丁中冰盐水的作用是______.
(4)经分析该套装置设计上有一处明显缺陷,改进方法是_____(用文字描述)。
(5)工业制得的NOC1中常含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.441g样品溶于适量的NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用0.8000mol/L硝酸酸化的AgNO3溶液滴定,若消耗AgNO3溶液的体积为25.00mL,则NOC1的质量分数为___%(保留2位小数);如果AgNO3溶液出现部分变质(变质的部分不参与反应),则测得的NOC1的质量分数会____(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向0.1 mol·L1的氨水中加少量硫酸铵固体,则溶液中![]() 增大
增大
B. 常温下,0.1 mol·L1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A)+KW
C. 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液得到沉淀的物质的量最多为 2 mol
D. 将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
B. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的是铁钉在水中被腐蚀的实验:

(1)甲图发生的是_________腐蚀,电极反应式是正极________,负极__________。
(2)乙图发生的是___________腐蚀,电极反应式是:正极________________,负极________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
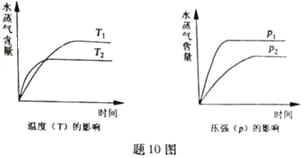
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com