
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
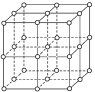
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。________
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于__,即(填计算式)____;Na+的个数等于____,即(填计算式)____。
(4)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
【答案】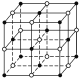 12 4 12×
12 4 12×![]() +1=4 4 8×
+1=4 4 8×![]() +6×
+6×![]() =4
=4 ![]()
![]() cm
cm
【解析】
(1)氯化钠晶体中钠离子、氯离子的配位数都是6;
(2)在NaCl晶胞中,Na+或Cl-所处的位置是顶点面心和棱边的中点,钠离子、氯离子的配位数都是6,所以与Na+最接近的且距离相等的Na+共有12个;
(3)根据均摊法求得每个晶胞中离子的个数;
(4)根据NaCl的摩尔质量为Mr gmol-1及密度为ρ gcm-3,求得晶胞的体积,进而求得棱边长,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,据此答题。
(1)氯化钠晶体中,钠离子或氯离子的配位数都是6,氯化钠晶体的结构示意图为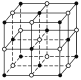 ;
;
(2)在NaCl晶胞中,Na+或Cl-所处的位置是顶点面心和棱边的中点,钠离子、氯离子的配位数都是6,所以与Na+最接近的且距离相等的Na+共有12个;
(3)根据均摊法:①处于顶点的离子,同时为8个晶胞共有,每个离子有![]() 属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有
属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有![]() 属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有
属于晶胞;③处于面上的离子,同时为2个晶胞共有,每个离子有![]() 属于晶胞;④处于晶胞内部(体心)的离子,则完全属于该晶胞。由此可知,在NaCl晶胞中,含Cl-:12×
属于晶胞;④处于晶胞内部(体心)的离子,则完全属于该晶胞。由此可知,在NaCl晶胞中,含Cl-:12×![]() +1=4个;含Na+:8×
+1=4个;含Na+:8×![]() +6×
+6×![]() =4个;
=4个;
(4)设晶胞边长为a,在NaCl晶胞中,含Cl-4个;含Na+4个,根据密度公式ρ=![]() ,可得a=
,可得a=![]() ,所以晶胞面对角线长为
,所以晶胞面对角线长为![]()
![]() ,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为
,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为![]()
![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体。旧|法合成的反应是:
①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:③CH3C≡CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列说法不正确的是
A.甲基丙烯酸甲酯有两种官能团B.反应③符合绿色化学思想
C.反应②中CH3OH是CH2OHCH2OH(乙二醇)的同系物D.反应①是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②是两种常见烃的球棍模型,则下列叙述正确的是( )
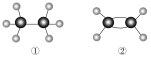
A.都能在空气中燃烧
B.都能使酸性高锰酸钾溶液褪色
C.都能发生加成反应
D.均为平面型分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知葡萄糖能和银氨溶液反应生成银单质。在一个熟苹果切片上分别滴上一滴碘水和银氨溶液,颜色变化如图所示。
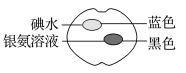
根据这些实验现象,下列推断正确的是( )
A.熟透的苹果中含有淀粉
B.熟透的苹果中不含淀粉
C.熟透的苹果中含有醇
D.熟透的苹果中不含还原性的糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图装置的说法正确的是( )
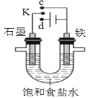
A. 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O
B. 若K与c连接,则溶液中的Na+向铁电极移动
C. 若K与d连接,铁电极的电极反应为:2H2O +2e-=H2↑+2OH-
D. 若K与d连接,短时间后,加适量稀盐酸可使电解质溶液复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g)2Y(g)+nZ(g)。2min末已生成0.2molY,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率为__。
(2)2min末时X的浓度为___。
(3)化学反应方程式中n=__。
(4)2min末,W的转化率__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2,下列说法不正确的是

A.由图分析N电极为负极
B.OH-通过离子交换膜迁向右室
C.反应完毕,该装置中电解质溶液的碱性增强
D.阴极的电极反应式为CO2+H2O+2e-=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO2,可以减少温室气体排放,还可以获得燃料或重要的化工产品。回答下列问题:
(1)CO2的捕集
①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。写出“捕集”CO2反应的离子方式_____________。
②聚合离子液体是目前广泛研究的CO2吸附剂。结合图像分析聚合离子液体吸附CO2的有利条件是_________________________。
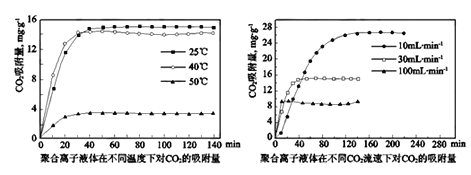
(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s)CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
①写出上述合成尿素的热化学方程式___________________________。该反应化学平衡常数K的表达式:_________________________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到___________min时到达平衡
(3)合成乙酸:中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式_______________________。
②根据图示,写出总反应的化学方程___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com