
 四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.
四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.| 阳离子 | K+、Fe3+、Ag+、Ca2+ |
| 阴离子 | Cl-、I-、CO32-、NO-3 |
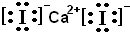 ;
;
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、②⑤ | B、②④⑤⑦ |
| C、②⑤⑥⑦ | D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
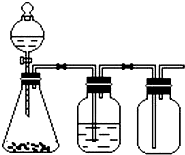 利用下列装置可以完成的实验组合是( )
利用下列装置可以完成的实验组合是( )| 选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
| A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
| B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
| C | Zn 稀硫酸 | 浓硫酸 | H2 |
| D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
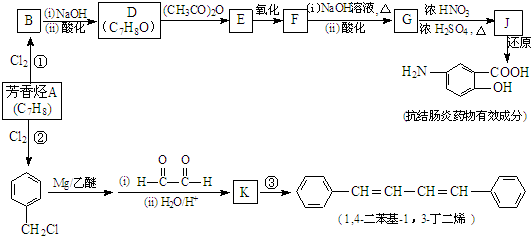
| ||
| (i)R′CHO |
| (ii)H2O/H+ |
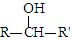 (R、R′表示烃基)
(R、R′表示烃基)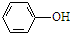
| (CH3CO)2O |
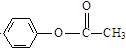
查看答案和解析>>
科目:高中化学 来源: 题型:
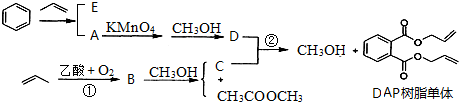
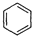 +2H2C=CH2
+2H2C=CH2| 一定条件 |
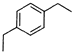
 +2H2C=CH2
+2H2C=CH2| 一定条件 |

| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com