考点:离子方程式的书写
专题:离子反应专题
分析:A.HI为强酸,完全电离,与铁离子发生氧化还原反应,生成氯化亚铁、碘和HCl;
B.恰好使SO42-反应完全,则反应生成硫酸钡、氢氧化铝和一水合氨;
C.等体积均匀混合,以2:5的物质的量反应,生成等量的氢氧化铝和氯化铝、水;
D.酸化的溶液中,不生成OH-.
解答:
解:A.向氯化铁溶液中滴加HI溶液的离子反应为2Fe3++2I-=2Fe2++I2,故A错误;
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全的离子反应为2Ba2++4OH-+NH4++Al3++2SO42-═2BaSO4↓+Al(OH)3↓+NH3.H2O,故B错误;
C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合的离子反应为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故C正确;
D.用过氧化氢从酸化的海带灰浸出液中提取碘的离子反应为2H++2I-+H2O2═I2+2H2O,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应为解答的关键,侧重与量有关的离子反应及氧化还原反应的考查,选项B为解答的难点,题目难度中等.



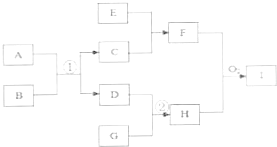 已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.
已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.