
实验是化学的基础。下图为一化学实验装置图,图中,夹持仪器已略去,用“△”表示用酒精灯加热。
请仔细观察该实验装置图,回答问题:
(1)甲装置通入空气的导气管插入乙醇中的主要目的是
(2)乙装置用揉乱的铜丝,好处是
(3)乙装置的化学反应反应方程式为 ,反应中,转移电子的数目是 若有23g乙醇发生反应,至少需要通入标准状况下的空气 L
(4)写出一种检验反应产物的方法及现象
(5)该反应还可以用更简便的方法实现:取一束铜丝在酒精灯上加热,铜丝变黑,趁热插入盛有少量乙醇的试管中,铜丝又变红;如此反复多次即可。请写出实验中发生反应的化学方程式 。
(1)可以通过观察气泡的流速调节空气的进入量
(2)有利于气体流通,并增加反应接触面积
(3)2CH3CH2OH+O2  2CH3CHO+2H2O 4e— 26.7
2CH3CHO+2H2O 4e— 26.7
(4)在碱性、加热条件下,与银氨溶液反应析出银(加热条件下,与新制的氢氧化铜反应,产生砖红色沉淀)
(5)2Cu+O2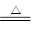 2CuO CH3CH2OH+CuO
2CuO CH3CH2OH+CuO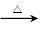 CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
解析试题分析:(1)通入空气的目的是提供氧气氧化乙醇,所以甲装置通入空气的导气管插入乙醇中的主要目的是可以通过观察气泡的流速调节空气的进入量,便于控制反应速率。
(2)乙装置用揉乱的铜丝,好处是有利于气体流通,并增加反应接触面积,加快反应速率。
(3)乙醇发生催化氧化的化学方程式是2CH3CH2OH+O2  2CH3CHO+2H2O,在反应中氧气中氧元素的化合价从0价降低到-2价,所以转移4个电子。23g乙醇的物质的量是23g÷46/mol=0.5mol,消耗氧气是0.5mol÷2=0.25mol,标准状况下的体积是0.25mol×22.4L/mol=5.6L,则需要空气的体积是5.6L÷0.21=26.7L。
2CH3CHO+2H2O,在反应中氧气中氧元素的化合价从0价降低到-2价,所以转移4个电子。23g乙醇的物质的量是23g÷46/mol=0.5mol,消耗氧气是0.5mol÷2=0.25mol,标准状况下的体积是0.25mol×22.4L/mol=5.6L,则需要空气的体积是5.6L÷0.21=26.7L。
(4)乙醇的氧化产物是乙醛,含有醛基,检验醛基的试剂和实验现象是在碱性、加热条件下,与银氨溶液反应析出银(或加热条件下,与新制的氢氧化铜反应,产生砖红色沉淀)。
(5)取一束铜丝在酒精灯上加热,铜丝变黑,这说明铜被氧化生成氧化铜,方程式是2Cu+O2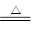 2CuO。趁热插入盛有少量乙醇的试管中,铜丝又变红,这说明在加热的条件下,氧化铜把乙醇氧化生成乙醛,而氧化铜被还原又生成铜,反应的化学方程式是CH3CH2OH+CuO
2CuO。趁热插入盛有少量乙醇的试管中,铜丝又变红,这说明在加热的条件下,氧化铜把乙醇氧化生成乙醛,而氧化铜被还原又生成铜,反应的化学方程式是CH3CH2OH+CuO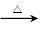 CH3CHO+Cu+H2O。
CH3CHO+Cu+H2O。
考点:考查乙醇发生催化氧化的实验探究
点评:该题是高考中的常见题型,属于中等难度的试题,侧重对学生实验能力的培养,有利于培养学生规范严谨的实验设计能力,有助于提升学生的学科素养。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


科目:高中化学 来源: 题型:实验题
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________ __,漂白粉的有效成分为 。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。 | |
| 步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入 | 现象: 结论: |
| 步骤3:取滤液分装A、B两支试管。向A试管, | 现象:溶液先变红色,然后褪色。 结论: |
| 步骤4:向B试管, | 现象:产生白色沉淀。 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol?L-1HCl、1 mol?L-1H2SO4、0.1 mol?L-1NaOH、0.1 mol?L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ | 说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ | ______________, 说明悬浊液中混有Cu( OH) 2。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图: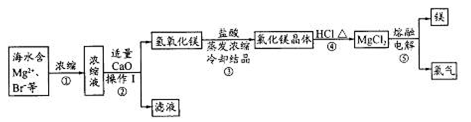
根据上述流程图,回答下列问题:
(1)操作I的名称是 。
(2)步骤中②反应的化学方程式为 。
(3)步骤④中加热时通入HCl气流的作用是 。
(4)步骤⑤的离子反应方程式为 。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a接( )接( )接( )接( )接f(填接口字母) ( )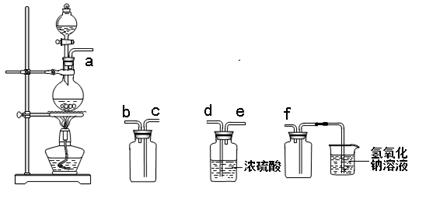
| A.b c d e | B.d e b c | C.d e c b | D.e d b c |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。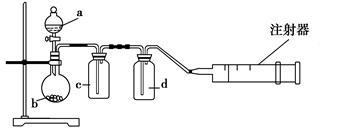
| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和 NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com