

| A. | 若X=5则HA为强酸 | |
| B. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$ 减小 | |
| C. | 由b到c,Kw不变 | |
| D. | a、c两溶液中n(H+)相等 |
分析 A.25℃时,pH=2的HA和HB各1mL分别加水稀释1000倍,若溶液PH=5说明为强酸,若PH<5则为弱酸;
B.将a点与b点两溶液同时升高温度,HA是强酸,c(A-)不变,而温度升高促进HB的电离,所以c(B-)变大;
C.Kw只与温度有关;
D.ac点氢离子浓度相同,溶液稀释倍数不同,溶液体积不同;
解答 解:A.25℃时,pH=2的HA和HB各1mL分别加水稀释1000倍,弱溶液PH=5说明为强酸,若X=5则HA为强酸,故A正确;
B.将a点与b点两溶液同时升高温度,HA是强酸,c(A-)不变,而温度升高促进HB的电离,所以c(B-)变大,所以$\frac{c({A}^{-})}{c({B}^{-})}$减小,故B正确;
C.Kw只与温度有关,所以b点、c点水的离子积常数Kw不变,故C错误;
D.ac点氢离子浓度相同,溶液稀释倍数不同,溶液体积不同,a、c两溶液中n(H+)不相等,故D错误;
故选D.
点评 本题考查强弱电解质溶液稀释时的pH、浓度变化,注意加水促进弱电解质电离的特点,题目难度中等.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用燃烧法可鉴别羊毛制品和涤纶制品 | |
| B. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 二氧化硫可广泛用于食品的增白 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:1 | B. | 1:10 | C. | 9:2 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 久置的植物油发出难闻的气味是因为发生了氧化反应 | |
| B. | 《本草钢木》记载民间酿酒的工艺:“凡酸坏之酒,皆可蒸烧…”,这里用到的分离坏酒的方法在原理上是化学变化 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的F-浓度相同时,它们的作用是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤时加入石灰石,可减少硫氧化物的排放 | |
| B. | 氯水中加入适量石灰石,可增强氯水的漂白性 | |
| C. | 酸性土壤中加入适量的熟石灰,可以中和其酸性 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)中施用熟石灰,可降低土壤的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
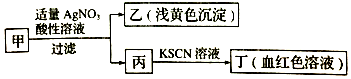
| A. | 如果甲中含有S2-,则乙是硫黄沉淀 | |
| B. | 丙中肯定含有Fe3+,所以甲是FeBr2溶液 | |
| C. | 甲中含有铁元素,可能显+2价或者+3价 | |
| D. | 若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{高温}^{H_{2}O(g)}$Fe2O3$→_{高温}^{Al}$Al2O3 | |
| B. | Cu$→_{点燃}^{Cl_{2}}$CuCl2$\stackrel{FeCl_{3}(aq)}{→}$FeCl2 | |
| C. | FeS2$→_{高温}^{O_{2}}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com