
 (1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀
(1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀分析 (1)根据沉淀溶解平衡移动的影响因素知识来回答判断;
(2)根据氢氧化铁的溶度积及pH=3计算出溶液中铁离子浓度;
(3)电离平衡常数指弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度系数次幂的乘积,与溶液中未电离分子的浓度系数次幂的乘积的比值,则H2CO3?HCO3-+H+的平衡常数K=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$;
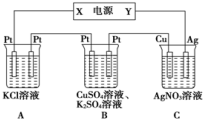
(4)①根据电极反应及电子守恒来计算;
②根据A中的电极反应及与C中转移的电子守恒来计算.
解答 解:(1,KSP[Fe(OH)3]<KSP[Mg(OH)2],氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,机会生成红褐色沉淀物质,
故答案为:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀;
(2)氢氧化铁的溶度积Ksp[Fe( OH)3]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol/L,c(Fe3+)=$\frac{4×1{0}^{-38}}{(1×1{0}^{-11})^{3}}$mol/L=4.0×10-5mol/L,
故答案为:4.0×10-5;
(3)饱和CO2水溶液的pH=5.6,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5 mol•L-1,
则H2CO3?HCO3-+H+的平衡常数,K=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{2.5×1{0}^{-6}×2.5×1{0}^{-6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,
故答案为:4.2×10-7 mol•L-1;
(4)①C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:0.025 mol•L-1;
②由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,故答案为:0.1mol•L-1.
点评 本题考查了沉淀的溶解平衡以及溶度积计算、电离平衡常数的计算以及电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸溶解四氧化三铁:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | Ca(HCO2)2溶液中滴加Ba(OH)2溶液至呈中性:Ca2++2HCO3-+Ca2++2OH-═2H2O+BaCO3↓+CaCO3↓ | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 1 molOH-含有的电子数为10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,HCN中C的化合价为-2.
,HCN中C的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: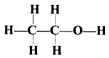 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com