(2012?河北区一模)研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)
2+CaCl
2+2H
2SO
42CaSO
4+2Cl
2↑+2H
2O.他们设计了如下制取氯气并验证其性质的实验.
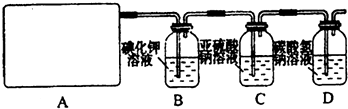
试回答:(1)该实验中A部分的装置是
b
b
(填写装置的序号).
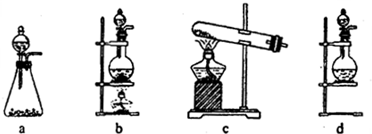
(2)(1)选项中d装置的两个主要的玻璃器皿的名称分别是
分液漏斗
分液漏斗
、
圆底烧瓶
圆底烧瓶
.
(3)请你设计一个实验,证明洗气瓶C中的Na
2SO
3已经被氧化(简述实验步骤):
取适量实验后的洗气瓶C中的溶液,加过量盐酸无沉淀产生,再滴加氯化钡溶液,
如产生白色沉淀,则证明洗气瓶C中的Na2SO3已经被氧化
取适量实验后的洗气瓶C中的溶液,加过量盐酸无沉淀产生,再滴加氯化钡溶液,
如产生白色沉淀,则证明洗气瓶C中的Na2SO3已经被氧化
.
(4)分别写出C装置、D装置发生反应的离子方程式
Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+,Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O或HCO3ˉ+Cl2=HClO+CO2↑+Cl-
Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+,Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O或HCO3ˉ+Cl2=HClO+CO2↑+Cl-
.
(5)该实验存在明显的缺陷,请你从化学反应的视角提出改进的方法是
在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中
在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中
.所发生反应的化学方程式是
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H
2SO
4溶液,静置.待完全反应后,用0.1mol/L的Na
2S
2O
3溶液作标准溶液滴定反应生成的碘,已知反应方程式为:
2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI 反应完成时,共用去Na
2S
2O
3 20.0mL.则该漂白粉中Ca(ClO)
2的质量分数为
35.75%
35.75%
.(保留至0.01%)



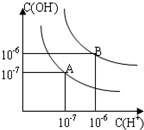 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: