
| A. | Mg>Na>F>O | B. | O>F>Na>Mg | C. | Na>Mg>O>F | D. | O>F>Na>Mg |
分析 Na+、Mg2+、F-、O2-四种离子具有相同的电子层结构,则原子序数Mg>Na>F>O,Mg、Na同周期,F、O同周期,且Mg、Na处F、O的下一周期,结合同周期自左而右原子半径减小,同主族自上而下原子半径增大判断.
解答 解:Na+、Mg2+、F-、O2-四种离子具有相同的电子层结构,则原子序数Mg>Na>F>O,Mg、Na同周期,F、O同周期,且Mg、Na处F、O的下一周期,结合同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以四种元素原子半径由大到小的顺序为:Na>Mg>O>F,
故选C.
点评 本题考查原子半径比较等,难度不大,确定元素的相对位置是关键,注意掌握微粒半径比较规律.


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 常温下,将pH=10的氨水稀释后,溶液中所有离子浓度都减小 | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | ||
| Y | ||
| Z |
| A. | Z一定是活泼的金属 | |
| B. | Y的最高化合价为+7价 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质与足量水反应时,有2mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子均不存在化学键 | |
| B. | 共价化合物中一定含有共价键,也可能含有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键,也可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池总反应:CH4+2O2+2OH-═CO32-+3H2O | |
| B. | 负极反应式:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极反应式:O2+4H++4e-═2H2O | |
| D. | CH4燃料电池比CH4直接燃烧能量利用率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g苯所含碳碳双键数目为0.3NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
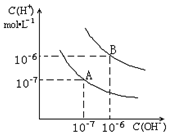 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com