
| 20 |
| 27 |
| 20 |
| 27 |


科目:高中化学 来源: 题型:
| A、6月26日是世界禁毒日,青少年要拒绝并远离毒品 |
| B、海洛因、冰毒等毒品损害人的肝脏、肾和脑,并使吸食者变得不负责任和不顾廉耻 |
| C、吸毒者危害社会,铤而走险,并且常常因共用针筒传播艾滋病 |
| D、出于好奇偶尔吸食几次毒品不会使人成瘾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯的结构简式:C3H6 |
B、羟基的电子式: |
C、氯原子的结构示意图: |
| D、中子数为146、质子数为92 的铀(U)原子238 92U |
查看答案和解析>>
科目:高中化学 来源: 题型:
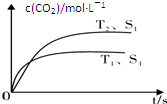
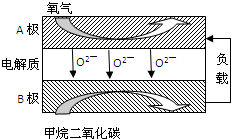
 如图装置中,已知A、B两池溶液的体积均为200mL:
如图装置中,已知A、B两池溶液的体积均为200mL:查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 的物质互为同分异构体,我们称之为顺反异构.则分子式为C5H10的有机物,属于烯烃的同分异构体的数目为
的物质互为同分异构体,我们称之为顺反异构.则分子式为C5H10的有机物,属于烯烃的同分异构体的数目为 的二氯代物有
的二氯代物有 的二氯代物有
的二氯代物有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,Fe是负极,发生还原反应,NiO2是正极,发生氧化反应 |
| B、蓄电池的电极可以浸入某种酸性电解质溶液中 |
| C、放电时,电解质溶液中的阴离子向正极方向移动 |
| D、充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com