
| A. | 某金属元素从化合态变为游离态时,该元素一定发生还原反应 | |
| B. | 含金属元素的离子,一定都是阳离子 | |
| C. | 金属阳离子被还原一定得到金属单质 | |
| D. | 在氧化还原反应中,金属单质一定被还原 |
分析 A.某金属元素从化合态变为游离态时,金属元素的化合价降低;
B.含金属元素的离子,可能为阴离子;
C.金属阳离子被还原可能得到单质、也可能为离子;
D.金属在氧化还原中失去电子.
解答 解:A.某金属元素从化合态变为游离态时,金属元素的化合价降低,则得到电子被还原,发生还原反应,故A正确;
B.含金属元素的离子,可能为阴离子,如AlO2-等,故B错误;
C.金属阳离子被还原可能得到单质、也可能为离子,如Fe3+被还原生成Fe2+,Fe2+被还原生成Fe,故C错误;
D.金属在氧化还原中失去电子,则金属单质被氧化,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,注意金属的性质及常见的实例,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
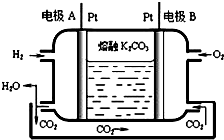 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
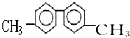
| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: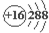 | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: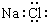 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CHBr=CHCH3 | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com