

| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
分析 (1)装置A的气密性的检查方法是连接装置后密闭装置,利用压强变化和液面变化分析设计检验方法;
①B中五氧化二磷是吸收生成的氨气;
②M干燥管中碱石灰防止污染气体进入空气;
(2)检验(NH4)2Fe(SO4)2•6H2O是否变质是检验是否存在铁离子;完全变质的检验方法是利用亚铁离子的还原性,利用高锰酸钾溶液颜色变化设计检验;
(3)①过二硫酸铵具有氧化性;
②第二次实验数据误差较大应舍去,计算平均消耗溶液体积,结合化学方程式定量关系计算;
解答 解:(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2•6H2O分解的部分产物.装置A的气密性的检查方法是:将装置A与导管相连,将该导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀.观察插入水中的导管是否有气泡.停止微热后,导管是否出现水柱,
故答案为:将装置A与导管相连,将该导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀.观察插入水中的导管是否有气泡.停止微热后,导管是否出现水柱;
①五氧化二磷是酸性干燥剂,可以吸收生成的氨气,
故答案为:除去NH3;
②分解生成的气体不能排放,通过M中碱石灰吸收防止污染空气,
故答案为:碱石灰;
(2)检验(NH4)2Fe(SO4)2•6H2O是否变质的试剂是KSCN溶液,若变质生成铁离子,加入KSCN溶液会变红色,检验是否完全变质的实验方法是利用亚铁离子的还原性,取少量样品于试管中,加入适量蒸馏水,振荡充分溶解,再滴加酸性高锰酸钾溶液,若紫色溶液变浅,则说明样品未完全变质;若紫色溶液不变色,说明样品已完全变质,
故答案为:KSCN; 取少量样品于试管中,加入适量蒸馏水,振荡充分溶解,再滴加酸性高锰酸钾溶液,若紫色溶液变浅,则说明样品未完全变质;若紫色溶液不变色,说明样品已完全变质;
(3)①滴定反应的离子方程式为:S2O82-+2Fe2+═2Fe3++2SO42-,反应可知过二硫酸铵具有强氧化性,所以准确量取20.00mL过二硫酸铵溶液,所用仪器的名称是酸式滴定管或移液管,
故答案为:酸式滴定管或移液管;
②第二次实验数据误差较大应舍去,计算平均消耗溶液体积=$\frac{22.58-2.50+19.92}{2}$ml=20ml,
S2O82-+2Fe2+═2Fe3++2SO42-
1 2
n cmol/L×20×10-3L
n=c×20×10-3×$\frac{1}{2}$mol,
250ml溶液中含过二硫酸铵c×20×10-3×$\frac{1}{2}$mol×$\frac{250}{25}$,
则过二硫酸铵[(NH4)2S2O8]的纯度=$\frac{c×20×1{0}^{-3}×\frac{1}{2}÷\frac{250}{20}×238}{W}$×100%,
故答案为:$\frac{c×20×1{0}^{-3}×\frac{1}{2}÷\frac{250}{20}×238}{W}$×100%.
点评 本题考查了物质组成的实验探究、物质性质、滴定实验、化学反应定量计算等,掌握基础是解题关键,题目难度中等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | A>B>D>C | B. | A>B>C>D | C. | C>D>A>B | D. | C>A>B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的硫酸10mL | B. | 0.25mol/L的盐酸20mL | ||
| C. | 18.4mol/L的硫酸30mL | D. | 0.3mol/L的硝酸20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
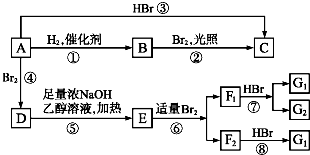
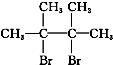 ,F1和F2、G1和G2分别互为同分异构体.
,F1和F2、G1和G2分别互为同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. $→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=12的NaAlO2溶液中,由水电离得OH-数目为0.01NA | |
| B. | 常温常压下,N2H4和CH3OH的混合物64g含有12NA个原子 | |
| C. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| D. | 苯与液溴反应生成1mol溴苯,消耗0.5NA个Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com