
| A、用Br2水可鉴别苯与乙醇 |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、用KMnO4溶液除去乙烯中的乙炔 |
| D、用适量HNO3除去NaNO3溶液中少量的Na2CO3 |


科目:高中化学 来源: 题型:
| A、Z可表示为MY2 |
| B、Z可表示为M2Y |
C、Z的电子式可表示为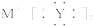 |
| D、M形成+2价阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨可用作制冷剂 |
| B、小苏打用于治疗胃酸过多 |
| C、明矾可用于自来水的杀菌消毒 |
| D、硅酸钠用于制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
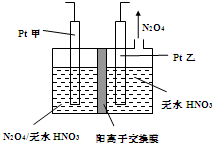 中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

| 180℃ |
| 催化剂 |
| 反应Ⅰ |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某高一化学课外活动小组进行下列实验.
某高一化学课外活动小组进行下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:
(1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B.根据以上条件回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com