
| A. | 未冷却即转移、定容 | B. | 容量瓶中原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线 | D. | 玻璃棒在刻度线上方引流溶剂水 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1=△H2+△H3 | D. | △H1+△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器体积不变,充入O2,平衡向右移动,O2的转化率一定增大 | |
| B. | 若容器体积不变,充入Ar,容器内压强增大,平衡向右移动 | |
| C. | 若容器体积不变,升高温度,平衡向左移动,平衡常数K减小 | |
| D. | 若容器压强不变,再充入1 mol SO2和0.5 mol O2,达到新平衡时c(SO2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制备 Fe(OH)2 并能较 长时间观察其颜色 | |
| B. |  探究温度对平衡移动的影响 | |
| C. |  验证铁发生析氢腐蚀 | |
| D. | 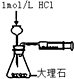 测定反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(P)=0.15 mol•L-1•min-1 | B. | v(Q)=0.6 mol•L-1•min-1 | ||
| C. | v(R)=0.9 mol•L-1•min-1 | D. | v(S)=0.4 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com