
| A. | 向生石灰中滴加浓氨水以制备纯净的氨气 | |
| B. | 用分液漏斗分离碘和四氯化碳 | |
| C. | 用排饱和硝酸钾溶液法收集铜与浓硝酸反应产生的NO | |
| D. | 向含Al3+的氯化镁溶液中加入过量MgO,过滤得到MgCl2溶液 |
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁电池放电时,Mg2+向负极移动 | |
| B. | 镁电池充电时,阳极发生的反应为:Mo3S42x--2xe-=Mo3S4 | |
| C. | 锂离子电池放电时,负极的电极反应式为 LixC6+xe-=xLi++C6 | |
| D. |  用镁电池给车载锂离子电池充电时连接方式如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验目的或结论 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 欲确定磷、砷两元素非金属性的强弱 | 测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和Na2CO3溶液除去SO2气体中含有的少量CO2 | |
| B. | 用加热的方法提取NH4Cl固体中混有的少量单质碘 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤的速度 | |
| D. | 用醋和KI淀粉溶液检验食用加碘盐中含有的碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
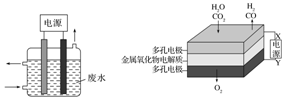 用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.
实验室可用氯酸钾与密度为1.19g•cm-3,溶质质量分数为36.5%的浓盐酸反应制取氯气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com