
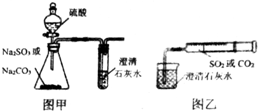
 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.分析 (1)亚硫酸钠与硫酸反应生成二氧化硫和水、硫酸钠;
(2)氢氧化钙溶液与足量二氧化硫反应生成可溶性亚硫酸钙和水;
(3)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快,所以以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快;
(4)二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
解答 解:(1)亚硫酸钠与硫酸反应生成二氧化硫和水、硫酸钠,方程式:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;
故答案为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;
(2)氢氧化钙溶液与足量二氧化硫反应生成可溶性亚硫酸钙和水,离子方程式:Ca(OH)2+2SO2═Ca(HSO3)2;
故答案为:反应时直接生成了酸式盐而看不到沉淀;Ca(OH)2+2SO2═Ca(HSO3)2;
(3)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快,所以以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快;
故答案为:SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快;
(4)二氧化硫与氢氧化钠反应生成亚硫酸钠和水,离子方程式:SO2+2OH-═SO32-+H2O;
故答案为:SO2+2OH-═SO32-+H2O;
点评 本题考查了二氧化硫的制备和性质,熟悉硫酸、二氧化硫的性质是解题关键,注意二氧化硫与二氧化碳与碱反应的相似性与区别,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |

| A. | 该电池的正极反应式为MnO2+eˉ+H+═MnOOH | |
| B. | 利用干电池,高温电解H2O-CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1 | |
| C. | 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离 | |
| D. | 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶液鉴别FeCl2和FeCl3溶液 | |
| B. | 用澄清石灰水鉴别SO2和CO2 | |
| C. | 用焰色反应鉴别NaCl溶液和KCl洛液 | |
| D. | 用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
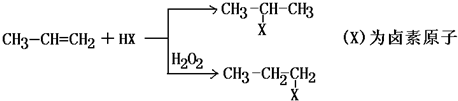

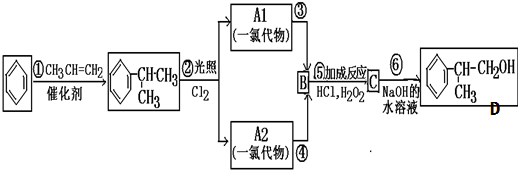
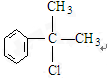
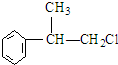 ,
,
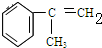 C的结构简式:
C的结构简式: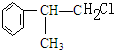 .
.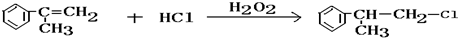 .
.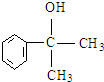 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com