
向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96L(0℃,1.01×105 Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图象正确的是(不考虑气体的溶解和离子与水反应) ( )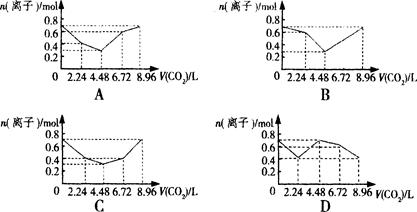
C
解析试题分析:n(CO2)=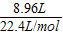 =0.4mol,通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,0.1molBa(OH)2完全反应消耗0.1molCO2,剩余0.2molOH-,生成0.1molBaCO3,然后发生2OH-+CO2=CO32-+H2O,消耗0.1molCO2,生成0.1molCO32-,上述两阶段共消耗0.2molCO2,剩余0.2molCO2,再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,据此计算解答.
=0.4mol,通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,0.1molBa(OH)2完全反应消耗0.1molCO2,剩余0.2molOH-,生成0.1molBaCO3,然后发生2OH-+CO2=CO32-+H2O,消耗0.1molCO2,生成0.1molCO32-,上述两阶段共消耗0.2molCO2,剩余0.2molCO2,再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,据此计算解答.
解答:解:含有0.2mol NaOH和0.1mol Ba(OH)2的溶液中离子总的物质的量为0.2mol×2+0.1mol×3=0.7mol,
n(CO2)=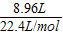 =0.4mol,
=0.4mol,
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.1mol,溶液中离子为0.4mol;
最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.3mol,溶液中中离子为0.7mol;故图象C符合,故选C.
考点: 考查离子方程式的计算


科目:高中化学 来源: 题型:填空题
铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)= mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是 。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案: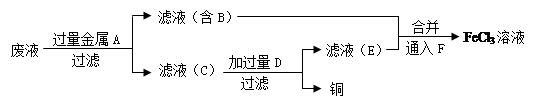
①滤渣C的化学式为 。
②加过量D发生反应的离子方程式为 。
③通入F发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有下列十种物质:①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | | 氧化物 | | | 电解质 |
| 属于该类的物质 | ② | | ⑧⑨ | ⑦ | |
 H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是
| A.等物质的量的Ba(OH)2与明矾[KAl(SO4)2·12H2O]加入足量水中: 3Ba2++6OH-+2Al3++3SO  ===3BaSO4↓+2Al(OH)3↓ ===3BaSO4↓+2Al(OH)3↓ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O |
C.H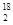 O中投入Na2O2固体:2H O中投入Na2O2固体:2H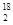 O+2Na2O2===4OH-+4Na++18O2↑ O+2Na2O2===4OH-+4Na++18O2↑ |
| D.CuCl2溶液中加入H2S溶液:Cu2++S2-===CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应的离子方程式错误的是
| A.碘水加到溴化钠溶液中:2 Br-+ I2=== 2I- + Br2 |
| B.氯气通入碘化钾溶液中:2I-+ Cl2=== 2Cl-+ I2 |
| C.氯气溶于水:Cl2+ H2O === 2H+ + Cl-+ ClO- |
| D.硝酸银溶液中滴加碘化钠溶液:Ag+ + I- === AgI↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由于反应物的浓度不同而引起的是
| A.Fe+H2SO4 | B.Cu+HNO3 | C.NaOH+ CO2 | D.AlCl3 +NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是( )
| A.澄清石灰水中滴加稀硫酸:Ca(OH)2+2H+=Ca2++2H2O |
| B.实验室用大理石和稀盐酸正确CO2:2H++CO32-= CO2↑+H2O |
| C.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓。 |
| D.过量的SO2与NaOH溶液反应:SO2+OH-=HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某溶液中可能含有H+、NH、Mg2+、Fe3+、Al3+、SO、HCO等离子中的一种或几种。当向该溶液中加入一定物质的量的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如下图所示。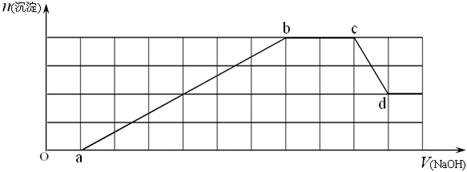
(1)原溶液中一定含有 ,一定不含有 ;
(2)cd段发生的离子反应为 ;
(3)原溶液中物质的量浓度最大的阳离子与原溶液中的阴离子的物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com