
【题目】用NA表示阿伏加德罗常数,下列有关说法正确的是( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为2NA
C.71gCl2所含原子数为2NA
D.23g钠在化学反应中失去电子数目为10NA
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)2SO3(g)△H<0.得到如表中的两组数据:

下列说法不正确的是( )
A. x=1.6,y=0.2,t<6 B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1 D. 实验1在前6 min的反应速率v (SO2)=0.2 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源.以下做法不能提高燃料效率的是 ( )
A.煤的汽化与液化
B.液体燃料呈雾状喷出
C.通入大大过量的空气
D.将煤粉粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验,请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是_______________________________________,此时锥形瓶内溶液的pH为________。
②根据上述数据,可计算出该盐酸的浓度约为____________________(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同温同压下,相同体积的气体,其气体分子物质的量也相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数可能不相等
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.同温同压下,若体积不相等,则一氧化碳气体和氮气质量可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或性质与应用均正确的是( )
A. Al2O3的熔点很高,可用于制作耐高温材料
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. 硅晶体是良好的半导体,可用于制造光导纤维
D. Al(OH)3是一种强碱,可以与酸反应,可用作医用的胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
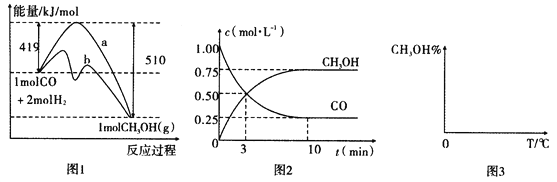
请回答下列问题:
(1)在“图1”中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是______________。
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线__________(在曲线上标出p1、p2,且p1>p2)。
(5)科学家常用量热剂来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2
(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com