(2011?锦州模拟)海水资源丰富,海水中主要含有Na
+、K
+、Mg
2+、Cl
-、SO
2-4、Br
-、CO
2-3、HCO
-3等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ.火力发电燃烧煤排放的SO
2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
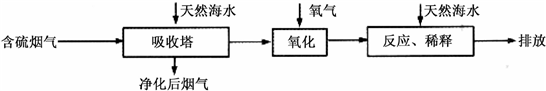
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因
CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-
CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-
.
(2)天然海水吸收了含硫烟气后,要用O
2进行氧化处理,其反应的化学方程式是
2H2SO3+O2═2H2SO4
2H2SO3+O2═2H2SO4
;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
中和、稀释经氧气氧化后海水中生成的酸
中和、稀释经氧气氧化后海水中生成的酸
.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g?mL
-1)中含有Ag
+、Pb
2+等重金属离子,其浓度各约为0.1mol?L
-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
AgI |
AgOH |
Ag2S |
pbI2 |
Pb(OH)2 |
PbS |
| Ksp |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(3)你认为往废水中投入
B
B
(填字母序号),沉淀效果最好.
A.NaOH B.Na
2S C.KID.Ca(OH)
2(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb
2+)=
1.2×10-3mol?L-1
1.2×10-3mol?L-1
.
(5)如果用食盐处理其只含Ag
+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag
+)低于1.0×10
-8mol?L
-1,问该工厂处理后的废水中c(Ag
+)=
9×10-9mol?L-1
9×10-9mol?L-1
,是否符合排放标准
是
是
(填“是”或“否”).
已知K
SP(AgCl)=1.8×1
-10mol?L
2.




 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】