
| A. | 如果5.6LN2含有n个氮分子,则NA一定约为4n | |
| B. | 18g水中所含的电子数是8NA | |
| C. | 在100mL0.5mol/L盐酸溶液中含有氯化氢分子数为0.05 NA | |
| D. | 23g Na+含有10mol电子 |
科目:高中化学 来源: 题型:选择题
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡向左移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
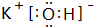 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 淀粉和纤维素的化学式都是(C6H10O5)n,因此它们互为同分异构体 | |
| C. | 分馏煤焦油可以得到苯和甲苯,说明煤中含有苯和甲苯等芳香烃 | |
| D. | 乙烯、苯、四氯化碳分子中所有原子都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| B. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组利用如下装置合成化工原料正丁醛.发生的反应如下:
某实验小组利用如下装置合成化工原料正丁醛.发生的反应如下:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com