
在一定条件下,可逆反应A2(g)+B2(g)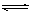 2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol·L-1,c(B2)=0.1mol·L-1,c(C)=1.6mol·L-1。若
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol·L-1,c(B2)=0.1mol·L-1,c(C)=1.6mol·L-1。若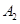 、
、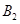 、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1请确定:
、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1请确定:
(l)a、g应满足的关系式为_____________。
(2)若反应从正反应方向开始进行,当g=_________,a有最大值为__________。
(3)若反应从逆反应方向开始进行,当b=_________,a有最小值为_________.
(4)b的取值范围为___________________。
(1)a+g∕2=1.3(2)0 1.3(3)0 0.4(4)0≤b≤0.9
解析试题分析:(1)对题目给定的反应平衡来说,它的等效起始状态为c(A2)=1.3mol·L-1,c(B2)=0.9mol·L-1,c(C)=0mol·L-1。或c(A2)=0.4mol·L-1,c(B2)=0mol·L-1,c(C)=1.8mol·L-1。故若A2 、B2、C的起始浓度分别为a mol·L-1、b mol·L-1、g mol·L-1可看做C的g mol·L-1是消耗反应物产生的,等效转化过去。a+g∕2=1.3 b+g∕2=0.9.若反应从逆反应方向开始,则a、b的关系是a-b=0.4,2b+g=1.8(2)若反应从正反应方向开始进行,由a+g∕2=1.3可知当g=0时,a取最大值,最大为1.3. (3)若反应从逆反应方向开始进行,由另一个等效起始状态c(A2)=0.4mol·L-1,c(B2)=0mol·L-1,c(C)=1.8mol·L-1可知:当b=0时,a取最小值,为0.4.(4)根据上述分析可知从正向开始,b取最大值;从逆向开始,b取最小值。所以b的取值范围是0≤b≤0.9。
考点:考查等效平衡和反应混合物中的各物质的取值范围等问题的知识。


科目:高中化学 来源: 题型:填空题
某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为 。
(2)该温度下,此可逆反应的逆反应的平衡常数为 。
(3)a的值为 。
(4)下列说法一定能说明上述反应已达到平衡状态的是 。
①单位时间里每生成1molB的同时消耗了2mol的C ②D的物质的量不再变化
③混合气体的密度不再变化 ④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)  aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: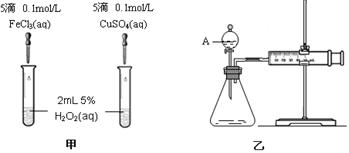
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是 ,
实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。实验过程中速率变化的趋势是 ,可能原因是 。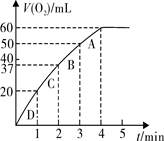
计算H2O2的初始物质的量浓度为 mol/L(请保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应: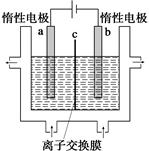
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入 (阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用 (阴、阳)离子交换膜,在阳极发生的电极反应式: 。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)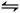 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应m A+n B p C在某温度下达到平衡
p C在某温度下达到平衡
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 。②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为______态。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)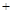 2H2(g)
2H2(g)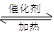 CH3OH(g)
CH3OH(g) Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施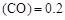 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v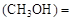 mol /(L·min),
mol /(L·min),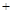 CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1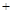 H2O(g)
H2O(g)  CO(g)
CO(g)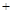 H2(g) 平衡常数K2
H2(g) 平衡常数K2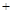 H2O(g)
H2O(g)  H2(g)
H2(g)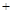 CO2(g) 平衡常数K3
CO2(g) 平衡常数K3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com