
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
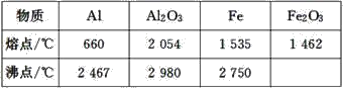
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__,反应的离子方程式为_。
(3)实验室溶解该熔融物,下列试剂中最好的是__(填序号),并说明理由:__。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
【答案】合理 NaOH溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑ B 若用A、C溶解样品会产生SO2、NO等有毒气体,用D,则Fe不会与NaOH溶液反应,而用B既能将样品全部溶解,又不会生成有害气体
【解析】
(1)根据表中各物质的熔点分析,铁和铝能否熔合成铁铝合金;
(2)由于金属铝可以与NaOH溶液反应而铁不能;铝与NaOH溶液反应的生成NaAlO2和H2,据此分析;
(3)要将熔融物全部溶解,则加入试剂必须既可以与铝反应也必须与铁反应,且环保无害;
(1)根据表中各物质的熔点,铁和铝可以熔合成铁铝合金,故解释合理;
故答案为:合理;
(2)由于金属铝可以与NaOH溶液反应而铁不能,故可以选用的试剂为NaOH溶液;铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)要将熔融物全部溶解,则加入试剂必须既可以与铝反应也必须与铁反应。若用A、C溶解样品会产生SO2、NO等有毒气体,用D,则Fe不会与NaOH溶液反应,而用B既能将样品全部溶解,又不会生成有害气体,
故答案为:B;若用A、C溶解样品会产生SO2、NO等有毒气体,用D,则Fe不会与NaOH溶液反应,而用B既能将样品全部溶解,又不会生成有害气体。


科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
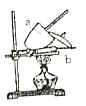
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+由H、C、N三种元素组成,结构如下图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为______,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,NH3、![]() 、
、![]() 中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是____________。
中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是____________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+中,碳原子的杂化轨道类型为________。分子中的大π键可用符号![]() 表示,其中n代表参与形成的大π键原子数,m代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中n代表参与形成的大π键原子数,m代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+中的大π键应表示为________。
),则EMIM+中的大π键应表示为________。
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如下图所示。立方氮化硼属于______晶体,其中硼原子的配位数为_____。已知:立方氮化硼密度为d g/cm3,B原子半径为x pm,N原子半径为y pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为_______(列出化简后的计算式)。
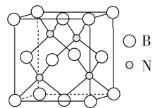
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

已知:![]() +CH3Cl
+CH3Cl![]() +HCl
+HCl
请回答下列问题:
(1)F的化学名称是__,②的反应类型是___。
(2)D中含有的官能团是__(写名称),D聚合生成高分子化合物的结构简式为___。
(3)反应③的化学方程式是___。
(4)反应⑥的化学方程式是___。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___。
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)___。
[示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br]
BrCH2CH2Br]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
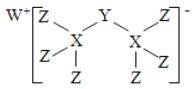
A. X、Z两元素可形成离子化合物
B. 气态氢化物的稳定性:X>Y>Z
C. 该新化合物中的Y元素满足8电子稳定结构
D. Y、Z元素分别对应的最高价氧化物的水化物均是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH1<0,平衡常数为K1;
2ClNO(g) ΔH1<0,平衡常数为K1;
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
(2)为研究不同条件对反应①的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应①达到平衡。测得10 min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=__________mol,NO的转化率α1=___________。其他条件保持不变,反应①在恒压条件下进行,平衡时NO的转化率为α2,α1____α2(填“>”“<”或“=”),平衡常数K1______________(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
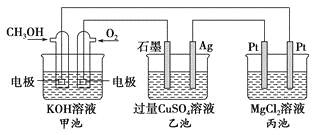
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g) ![]() cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
cQ(g),气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是
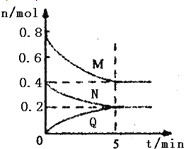
A. 该温度下此反应的平衡常数的值K=25/4
B. 平衡时,M的转化率为50℅,若条件改为恒温恒压,则达平衡时M的转化率小于50℅
C. 若开始时向容器中充入2molM和1molN,达到平衡时,M的体积分数小于50℅
D. 在5min时,再向体系中充入少量He,重新达到平衡前v(正)>V(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com