
 .
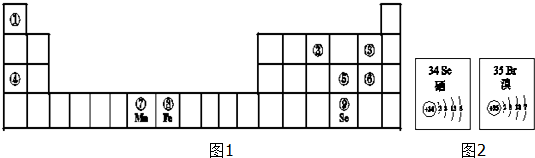
.分析 参照①~⑨在表中的位置,这几种元素分别是H、N、F、Na、S、Cl、Mn、Fe、Se元素,
(1)原子核外电子层数越少其原子半径越小,同一周期元素,原子半径随着原子序数增大而减小;
②的氢化物是氨气,氨气极易溶于水,水溶液显碱性;
(2)元素的非金属性越强,其氢化物热稳定性越强;
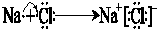
④和⑥通过得失电子形成离子化合物氯化钠,用电子式表示④和⑥形成化合物的过程;
(3)a.电子层数越多其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
b.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
c.根据S的氧化物写出Se的氧化物;
d.在水中Br2 和SeO2发生氧化还原反应生成HBr和硒酸;
(4)同一主族元素,元素非金属性随着原子序数增大而减弱;
(5)SeO2属于酸性氧化物,且Se元素化合价处于中间价态,既有氧化性又有还原性;
(6)Mn属于较活泼金属,可以采用热还原法冶炼.
解答 解:参照①~⑨在表中的位置,这几种元素分别是H、N、F、Na、S、Cl、Mn、Fe、Se元素,
(1)原子核外电子层数越少其原子半径越小,同一周期元素,原子半径随着原子序数增大而减小,电子层数最少的元素是H元素,所以原子半径最小的是H元素;
②的氢化物是氨气,氨气极易溶于水,一水合氨电离出氢氧根离子而导致其水溶液显碱性,
故答案为:H;碱;
(2)元素的非金属性越强,其氢化物热稳定性越强,这几种元素非金属性最强的是F元素,所以HF的稳定性最强;
④和⑥通过得失电子形成离子化合物氯化钠,用电子式表示④和⑥形成化合物的过程为 ,
,
故答案为:HF; ;
;
(3)a.电子层数越多其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以原子半径Se>Br>P,故错误;
b.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>Br>Se,所以酸性:HClO4>HBrO4>H2SeO4,故正确;
c.根据S的氧化物写出Se的氧化物为SeO2、SeO3,故正确;
d.在水中Br2 和SeO2发生氧化还原反应生成HBr和硒酸,反应方程式为Br2+SeO2+2H2O═2HBr+H2SeO4,故正确;
故选bcd;
(4)S和Se处于同主族,从上到下,原子核外电子层数增多,原子半径增大,S得电子的能力强于Se,因此非金属性S强于Se,
故答案为:强;S和Se处于同主族,从上到下,原子核外电子层数增多,原子半径增大,S得电子的能力强于Se,因此非金属性S强于Se;
(5)SeO2属于酸性氧化物,具有酸性氧化物通性,且Se元素化合价处于中间价态,既有氧化性又有还原性,故答案为:酸性氧化物通性;既有氧化性又有还原性;
(6)Mn属于较活泼金属,可以采用热还原法冶炼,故选b.
点评 本题考查元素周期表和元素周期律综合应用,为高频考点,涉及金属冶炼、元素周期律、物质结构、物质性质等知识点,熟悉金属活泼性与金属冶炼关系、同一周期同一主族元素性质递变规律及物质结构等知识点即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 氢氧化钡晶体和氯化铵晶体的反应 | B. | 能量变化如右图所示的反应 | ||
| C. | 不需要加热就能够发生的反应 | D. | 铁与盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体干冰的熔点、沸点与干冰的相同 | |
| B. | 原子晶体干冰结构与二氧化硅结构不同 | |
| C. | 原子晶体干冰硬度大,可用作耐磨材料 | |
| D. | 每摩尔原子晶体干冰中含4mol氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>H3PO4 | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 热稳定性:Na2CO3>NaHCO3 | D. | 非金属性:Cl>Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气使品红溶液褪色 | |
| B. | NO2 通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 将铁片放入CuSO4溶液中,铁片表面有红色物质出现 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com