
【题目】有机物W是合成某药物的中间体,其结构简式如下:
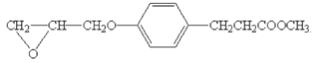
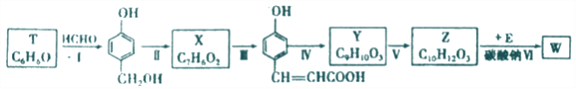
以有机物T为原料合成W的流程如图(部分条件省略):
己知:RCH2ONa+CH3CH2X![]() RCH2OCH2CH3+NaX
RCH2OCH2CH3+NaX
请回答下列问题:
(1) Y中所含的官能团有_______.
(2)步骤Ⅵ中Na2CO3的作用为_______。
(3)请写出下列各步骤的反应类型:Ⅰ.__________;Ⅱ._________;Ⅴ.__________。
(4)利用步骤I的反应物,可制备某线型结构高分子,请写出相关化学反应方程式__________。
(5)物质X 最多可消耗H2______mol ,最终产物与足量HCOOH 完全反应的方程式为_______ 。
(6)写出同时满足下列条件的Y的所有同分异构体的结构简式:_______。
① 苯环上只有一个取代基
② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等
③ 在核磁共振氢谱图上有7个峰
【答案】 羟基、羧基 与酚羟基反应生成酚钠 加成反应 氧化反应 酯化反应(或取代反应) 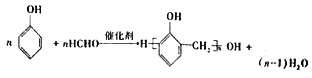 4
4 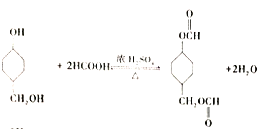
![]()
![]()
![]()
【解析】根据流程图,T为苯酚(![]() ),与甲醛发生加成反应生成
),与甲醛发生加成反应生成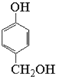 ,根据X的化学式C7H6O2可知,
,根据X的化学式C7H6O2可知, 氧化生成X(
氧化生成X(![]() ),根据Y的化学式C9H10O3可知,Y为
),根据Y的化学式C9H10O3可知,Y为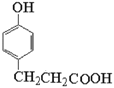 ,根据Z的化学式C10H12O3可知,Y与甲醇酯化生成Z,Z为
,根据Z的化学式C10H12O3可知,Y与甲醇酯化生成Z,Z为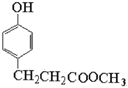 ,根据已知信息,最后Z首先与碳酸钠反应生成醇钠,再与 E(
,根据已知信息,最后Z首先与碳酸钠反应生成醇钠,再与 E(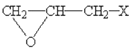 )反应生成W。
)反应生成W。
(1) Y为 ,其中所含的官能团有羟基、羧基,故答案为:羟基、羧基;
,其中所含的官能团有羟基、羧基,故答案为:羟基、羧基;
(2)步骤Ⅵ中Na2CO3的作用为与酚羟基反应生成酚钠,故答案为:与酚羟基反应生成酚钠;
(3)根据上述分析,反应Ⅰ为加成反应;反应Ⅱ为氧化反应;反应V为酯化反应,故答案为:加成反应;氧化反应; 酯化反应;
(4)苯酚与甲醛反应可以生成线型结构高分子,反应的化学反应方程式为 ,故答案为:
,故答案为: ;
;
(5)X为![]() ,1molX 最多可与4molH2加成,最终产物为
,1molX 最多可与4molH2加成,最终产物为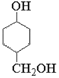 ,
, 与足量HCOOH 完全反应的方程式为
与足量HCOOH 完全反应的方程式为 ,故答案为:4;
,故答案为:4; ;
;
(6)Y为 ,① 苯环上只有一个取代基;② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等,说明分子中含有相同数目的羟基和羧基;③ 在核磁共振氢谱图上有7个峰;满足条件的Y的同分异构体有:
,① 苯环上只有一个取代基;② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等,说明分子中含有相同数目的羟基和羧基;③ 在核磁共振氢谱图上有7个峰;满足条件的Y的同分异构体有:![]() 、
、![]() 、
、 ![]() ,故答案为:
,故答案为: ![]() 、
、![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①正常雨水的pH为7.0,酸雨的pH小于7.0;
②严格执行机动车尾气排放标准有利于防止大气污染;
③Fe2O3常用作红色油漆和涂料;
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害;
⑤SiO2可用于制太阳能电池。
A. ①②③ B. ①④⑤
C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是 ( )
A. 铜合金有青铜,黄铜和白铜等
B. 合金具有优良的物理,化学或机械性能,但其熔点一般低于它的成分金属
C. 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝
D. 生铁、普通钢和不锈钢中的含碳量依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是____________。
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

① 一段脱水后,残留固体质量占原样品质量的64.5%,试确定生成物的化学式__________。② 二段脱水时,溶入H2和Cl2燃烧产物的目的是__________。
③ 该工艺中可循环使用的物质有_____________
(3)储氢材料Mg(AlH4)2在110-200℃的反应为:Mg(AlH4)2 =MgH2 +2Al+3H2↑,每转移6mol电子生成氢气的物质的量为__________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。
① 40℃时,复盐开始热解生成MgCO3·3H2O,并有气体产生,该反应的化学方程式为________。
② 制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL 的溶液。
a.准确量取25.00mL 待测液,用0.1000 mol/ L AgNO3 标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为______________mL。

b.
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
① CaCl2 ② NaBr ③ NaI ④ K2CrO4
c.滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是________。
d.产品中氯的质量分数为___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A. “地沟油”可以转化为生物柴油,提高资源的利用率
B. 丝绸和棉花的组成元素不完全相同
C. 木糖醇虽然有甜味,但不属于糖类
D. 向牛奶中加入果汁会出现沉淀,这是因为发生了中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的的是
A. 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,充分振荡静置后,分液
B. 苯(苯酚):加入浓溴水,过滤
C. 乙醇(水):加入金属钠,蒸馏
D. 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有pH=2的HX溶液和HY溶液各1mL ,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是
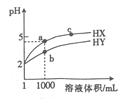
A. a、c两点对应HX的电离平衡常数:K(c)>K(a)
B. a、b两点对应的溶液中:c(X-)>c(Y-)
C. 等物质的量浓度的NaX和NaY的混合溶液中:c(HY)>c(HX)
D. 分别向10mL0.1mol/LHX溶液和10mL 0.1mol/L HY溶液中滴加同浓度的氢氧化钠溶液至pH = 7,消耗氢氧化钠溶液较少的是HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5 g Zn放入500mL稀盐酸中,Zn与HCl都恰好完全反应。计算:
(1)6.5 g Zn的物质的量_______________;
(2)生成的气体在标准状况下的体积_____________;
(3)原稀盐酸的物质的量浓度_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com