
将除去氧化膜的镁条投入盛有稀盐酸的试管中,发现生成氢气的速率变化曲线如下图所示。在t1~t2时间段内生成氢气的速率逐渐增大,其原因是_________;而t2~t3时间段内生成氢气的速率逐渐降低,其原因是________________________。
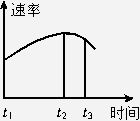
反应放出的热量使得溶液温度升高,增大反应速率的影响大于氢离子浓度降低所造成的降低反应速率的影响;
氢离子浓度不断降低对反应速率的影响大于反应放热对反应速率的影响


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:新课程模块教与练·高中化学必修2(苏教版) 苏教版 题型:043
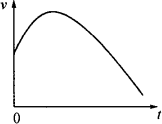
解释化学反应的反应速率变化曲线:将除去氧化膜的镁条投入盛稀盐酸的试管中,产生氢气的速率随时间的变化关系如图.
查看答案和解析>>
科目:高中化学 来源:2014届广东省高一下学期期中考试化学试卷(解析版) 题型:实验题
(10分)某同学做同周期元素性质递变规律实验时,设计了一套实验方案,并记录了有关实验现象(见下表,表中左右的“实验方案”与“实验现象”不一定是对应关系)。
|
实验方案 |
实验现象 |
|
①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
|
②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
|
④将除去氧化膜的镁条投入稀盐酸中 |
D.反应不十分剧烈,产生无色气体 |
|
⑤将除去氧化膜的铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
|
⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究第3周期元素性质的递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等。
仪器:砂纸,试管,试管夹,① ,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,
② 等。
(3)实验内容:
|
实验方案 |
② |
④ |
⑥ |
|
实验现象(填A~F) |
|
|
|
①的化学方程式 ,
②的离子方程式 。
(4)实验结论: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com