
【题目】现有镁铝铜合金1.2 g,加入过量的盐酸中,在标准状况下放出氢气1.12 L,反应后过滤得沉淀0.2 g。若将此合金放入过量的烧碱溶液中,反应后,在标准状况下,产生氢气的体积约为多少?
【答案】0.75L
【解析】
加盐酸发生Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,反应后过滤得到的沉淀0.2g为Cu的质量,将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,以此计算。
由上述分析可知,Cu为0.2g,设Mg为xmol、Al为ymol,由Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑列式得:①24x+27y=1.2-0.2、②x+1.5y=![]() ,解得y=
,解得y=![]() mol,将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成气体为
mol,将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成气体为![]() mol
mol![]() 22.4L/mol=0.75L,故答案为:0.75L。
22.4L/mol=0.75L,故答案为:0.75L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于烯烃、炔烃的叙述中,正确的是
A. 结构简式为CH3CH2CH(CH3)CH(OH)CH3的名称为3-甲基-2-羟基戊醇
B. CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. β-月桂烯的结构如图所示(![]() ),该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有4种
),该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和硫化氢都是有毒物质,但它们在工业上都有着重要的用途。请回答下列有关问题:
(1)燃煤脱疏是科研工作者研究的重要课题之一,己知有两种脱硫方法,一是活性炭作化氧化法脱流;二是CO还原法脱硫。
①活性炭在反应过程中作为催化剂,改变了______(填选项字母)。
a.反应限度 b.反应速率 c.反应活化能 d.反应焓变 e.反应路径
②CO还原法的原理是:2CO(g)+SO2(g)![]() S(g)+2CO2(g),△H。
S(g)+2CO2(g),△H。
已知:S(g)+O2(g)=SO2(g),△H1=-574.0kJ/mol,CO的燃烧热为283.0kJ/mol,则△H=___。
③在两个容积为10L的恒容绝热密闭容器中发生反应:
2CO(g)+SO2(g)![]() S(g)+2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲______K乙(填“>”“=”或“<”),理由是__________。
S(g)+2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲______K乙(填“>”“=”或“<”),理由是__________。

(2)H2S受热发生分解反应:2H2S(g)=2H2(g)+S2(g),在密闭容器中,充入0.20molH2S(g),压强为p时,控制不同的温度进行实验,H2S的平衡转化率如图所示。

①出强为p,温度为T6℃时,反应经tmin达到平衡,则平均反应速率v(S2)=_______mol/min.
②若压强p=aMPa,温度为T4℃时,该反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入由惰性电极组成的电解池中进行电解,阳极区可生成Sx2-。请写出生成Sx2-的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物X为原料合成聚酯类高分子化合物H的路线如下: 
已知:
回答下列问题:
(1)X中宫能团的名称为______,Y→Z的反应类型为_______。
(2)H的结构简式是______ 。
(3)W与NaOH水溶液反应的化学方程式为_______ 。
(4)M在一定条件下还可以合成含有六元环状结构的G,其反应方程式为______ 。
(5)满足下列条件的Z的同分异构体有______种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀
(6)参照题中合成路线图,设计以![]() 为原料(其它无机试剂任选)制备化合物
为原料(其它无机试剂任选)制备化合物 的合成路线如下:
的合成路线如下:
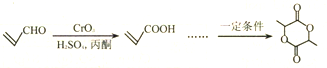 请把路线图中“……”补充完整____________________________。
请把路线图中“……”补充完整____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:

则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:

①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______

A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。

①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。

(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:

①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com