
在一 定条件下,对于A2(g)+3B2(g)
定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的
2AB3(g)反应来说,下列所表示的化学反应速率中最大的 是
是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=40 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
科目:高中化学 来源: 题型:选择题
| A. | 由KClO3变成KCl必须加入还原剂 | |
| B. | 向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低 | |
| C. | 已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10% | |
| D. | 一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
下列实验操作中错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸发结晶时应将溶液蒸干
C. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
D. 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol 的CuSO4(s)溶于水会使溶液温度升高, 热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s)
热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s)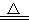 CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B .ΔH1>ΔH3
.ΔH1>ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知:C(s)+H2O(g)===CO (g) +H2 (g) ΔH=a kJ·mol-1
2C(s)+ O2(g)===2CO (g) ΔH= - 220 kJ·mol-1
H-H、O==O和O- H键的键能分别为436、496和462 kJ·mol-1,则 a 为
H键的键能分别为436、496和462 kJ·mol-1,则 a 为
A.-332 B.+130 C.+350 D.-118
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
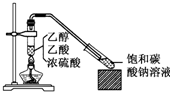 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )
实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )| A. | 制备的乙酸乙酯中混有乙酸和乙醇杂质 | |
| B. | 该实验中浓硫酸的作用是催化和吸水 | |
| C. | 饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
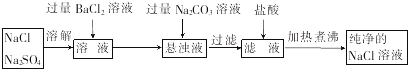
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
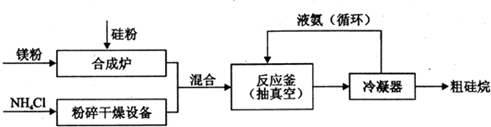
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com