
| A. | 标准状况下,1LC2H5OH燃烧后生成的CO2分子数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 电解食盐水水时,当产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 标准状况下,11.2LCH4和C2H4混合气体中含有碳原子的数目为2NA | |
| D. | NH3易溶于水,3.4gNH3溶于1LH2O,溶液中氮原子总数为0.6NA |
分析 A、标况下乙醇为液态;
B、氢气所处的状态不明确;
C、甲烷和乙烯中含有的碳原子个数不同;
D、求出氨气的物质的量,然后根据氨气中含1个氮原子来分析.
解答 解:A、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、氢气所处的状态不明确,故氢气的物质的量无法计算,故B错误;
C、甲烷和乙烯中含有的碳原子个数不同,故标况下11.2L甲烷和乙烯的混合气体即0.5mol混合气体中含有的碳原子个数无法计算,故C错误;
D、3.4g氨气的物质的量为0.2mol,而氨气中含1个氮原子,故0.2mol氨气溶于水后溶液中含有的氮原子个数为0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:解答题
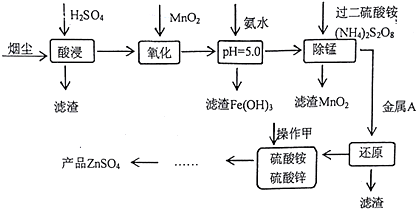
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和铁都是具有多种化合价金属,所同条件下与氧气反应时能得到不同的产物 | |
| B. | 将钠暴露在空气中,表面形成较为疏松的氧化膜,不能阻止其被继续氧化 | |
| C. | 钠元素的化学性质活泼,主要表现为具有还原性 | |
| D. | 金属铝的化学性质稳定,可以用来做日常用的铝制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g•mol-1 | B. | 16 g•mol-1 | C. | 32 | D. | 64 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
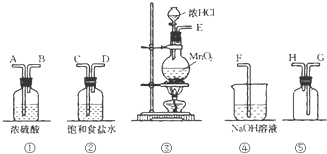 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com