
| A.与铜质水龙头连接处的钢制水管易发生腐蚀 |
| B.把被保护的钢铁设备作为阴极,外加直流电源可进行保护 |
| C.原电池产生电流时,阳离子移向正极,阴离子移向负极 |
| D.铅蓄电池是最常见的二次电池,正极板上覆盖有Pb |
科目:高中化学 来源:不详 题型:单选题
| A.通甲醇一极为正极。 |
| B.正极电极反应式 3O2 + 12H+ + 12e- = 6H2O |
| C.电池工作时电子从氧气一极流向甲醇一极。 |
| D.当转移24mol e-时,消耗的甲醇2mol。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
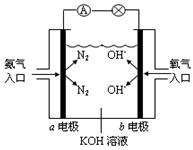
 燃烧生成气态水的热化学方程式:__________________________;
燃烧生成气态水的热化学方程式:__________________________;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li-Al在电池中作为负极材料,负极的电极反应式为Li-e-=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
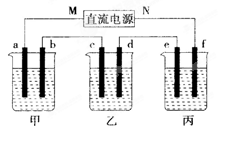
 电解前后各溶液的酸碱性大小是否发生变化,简述其原因:
电解前后各溶液的酸碱性大小是否发生变化,简述其原因: 乙溶液:______________________________________;
乙溶液:______________________________________;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 、
、 、
、 )等跟
)等跟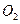 (或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如
(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如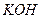 )溶液,下列关于甲烷燃料电池的说法中不正确的是:
)溶液,下列关于甲烷燃料电池的说法中不正确的是:A.负极的电极反应式为: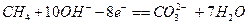 |
| B.通入氧气的一极发生氧化反应,通入甲烷的一极发生还原反应 |
| C.随着反应的进行,电解质溶液的pH保持不变 |
| D.甲烷燃料电池的能量利用率比甲烷燃烧的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com