


科目:高中化学 来源: 题型:
| A、3 mol/L |
| B、4 mol/L |
| C、5 mol/L |
| D、6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA
正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA | 充电 |
| 放电 |
| A、a是电池的负极 |
| B、放电时,A-离子向b极移动 |
| C、放电时,负极的电极反应式是nC-e-+A-=CnA |
| D、充电时,电解质中的离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
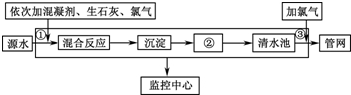
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第一步需选用仪器①、②和⑨,①的名称叫钳埚B.第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和 |
| B、第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦ |
| C、要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 |
| D、第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当隔板K不动时,M、N中反应均达到平衡状态 | ||
| B、改变温度,隔板K可停在左边2处 | ||
C、若隔板K停留在左边1处,则α(SO2)=α(O2)=
| ||
| D、达到平衡时,M、N中气体压强仍相等,且小于初始时的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
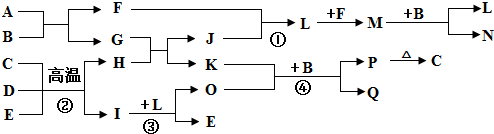
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
| B、标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NA |
| C、16g CH4与18 g NH4+ 所含质子数相等 |
| D、1molCu在足量硫蒸气中反应时转移2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com