
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
分析 X的一种1:2型氢化物分子中既有σ键又有π键,所有原子共平面,说明该氢化物中含有双键或三键,氢化物中乙烯中含有σ键和π键,且是1:2型氢化物,所以x是C元素;Z的L层上有2个未成对电子,则L层上有6个电子,所以Z为O元素;Q原子s能级与P能级电子数相等,则Q的电子排布为1s22s22p63s2,所以Q为Mg元素;R单质是制造各种计算机、微电子产品 的核心材料,则R为Si元素;T处于周期表的ds区,原子中只有一个未成对电子,则T为Cu元素;X、Y、Z、G、Q、R、T原子序数依次增大,Y为N元素;G能形成氟化物,且其原子序数小于Mg,则G为Na元素,根据以上元素的性质,结合选项解答.
解答 解:X的一种1:2型氢化物分子中既有σ键又有π键,所有原子共平面,说明该氢化物中含有双键或三键,氢化物中乙烯中含有σ键和π键,且是1:2型氢化物,所以x是C元素;Z的L层上有2个未成对电子,则L层上有6个电子,所以Z为O元素;Q原子s能级与P能级电子数相等,则Q的电子排布为1s22s22p63s2,所以Q为Mg元素;R单质是制造各种计算机、微电子产品 的核心材料,则R为Si元素;T处于周期表的ds区,原子中只有一个未成对电子,则T为Cu元素;X、Y、Z、G、Q、R、T原子序数依次增大,Y为N元素;G能形成氟化物,且其原子序数小于Mg,则G为Na元素,
(1)Y为N元素,其电子排布图为: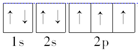 ,所以其原子核外共有7种不同运动状态的电子;Cu原子的电子排布式为1s22s22p63s23p63d104s1,所以Cu原子有7种不同能级的电子,
,所以其原子核外共有7种不同运动状态的电子;Cu原子的电子排布式为1s22s22p63s23p63d104s1,所以Cu原子有7种不同能级的电子,
故答案为:7;7;
(2)C、N、O为同周期元素,同周期元素第一电离能从左到右依次增大,但是第IIA族与第IIIA族反常,第VA族与第VIA族反常,所以)C、N、O的第一电离能由小到大的顺序为:C<O<N,
故答案为:C<O<N;
(3)已知CO2与CNO-为等电子体,则二者的空间结构和和杂化方式相同,已知为CO2直线形,C为sp杂化,所以CNO-中C为sp杂化,
故答案为:sp杂化;
(4)化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O 键,所以1mol二氧化硅中含有4molSi-O 键,SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为$\frac{4+4}{2}$=4,所以SiF4的空间构型为正四面体,H2O中氧原子的价层电子对数为$\frac{6+2}{2}$=4,所以H2O的空间构型为v形,
故答案为:4; SiF4为正四面体形、H2O为V形;
(5)不同晶体熔点的一般规律是:离子晶体的熔点>分子晶体的熔点,离子晶体中半径越小,所带电荷越多,熔点越高,NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(6)向Cu的硫酸盐溶液中逐滴加入氨水至过量,开始生成氢氧化铜沉淀,后来沉淀溶解生成四氨合铜离子,其反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
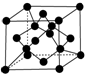
(7)C单质的晶胞如图所示,在顶点上8个原子,面心上2个原子,晶体内部为4个原子,所以一个C晶胞中原子数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,设晶体中最近的两个X原子之间的距离为xcm,晶胞的边长为acm,则a3=$\frac{\frac{12×8}{{N}_{A}}}{ρ}$,由晶胞图可知a2+a2=(4x•sin$\frac{109°28′}{2}$)2,所以2$\root{3}{\frac{12}{ρ{N}_{A}}}$=2$\sqrt{2}$x•sin$\frac{109°28′}{2}$;
所以x=$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$,
故答案为:8;$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$.
点评 本题考查了元素的推断,涉及了电子的运动状态的判断,电负性的比较,物质熔沸点的比较,离子方程式的书写,晶胞的有关计算,考查的知识点较多,题目难度较大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
 如表各组物质中,不能通过一步反应实现如图所示转化的是( )
如表各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | NH4Cl | NH3 | NO |
| C | C | CO | CO2 |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氧气中燃烧时,存在化学键的断裂和形成 | |
| B. | 有化学键断裂的过程一定是化学变化 | |
| C. | 化学反应过程中,所有反应物中都要断裂化学键 | |
| D. | 干冰升华时,分子中的共价键发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用的酸过量 | B. | 生成的盐不水解 | ||
| C. | 酸与碱等物质的量混合 | D. | 反应后溶液中c(A-)=c(M+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com