
分析 已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1;
②H2O(g)?H2O(l)△H2=-44kJ•mol-1;
③2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1.
根据盖斯定律,(③-①-②)÷2可得:SO3(g)+H2O(l)=H2SO4(l),则△H=(△H3-△H1-△H2)÷2.
解答 解:已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1;
②H2O(g)?H2O(l)△H2=-44kJ•mol-1;
③2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1
根据盖斯定律,(③-①-②×2)÷2可得:SO3(g)+H2O(l)=H2SO4(l),则△H=(△H3-△H1-2△H2)÷2=[-545kJ•mol-1-(197kJ•mol-1)-2×(-44kJ•mol-1)]=-130kJ•mol-1,
故热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ•mol-1,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ•mol-1.
点评 本题考查运用盖斯定律书写热化学方程式,关键是对盖斯定律的理解,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 浓度均为0.1mol--1L的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$不变 | |
| D. | 0.2mol-L-1 CH3COOH溶液中c(H+)与 0.1mol-L-1 CH3COOH溶液中c(H+)的比值小于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将材料均匀分散到某液体分散剂中,该分散系可发生丁达尔现象,由此可推测该材料的直径为1~100pm之间 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
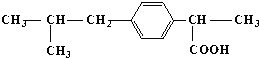
| A. | ③⑤ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | O→a时的反应的离子方程式为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2 H2O | |
| B. | a→b时发生的离子反应为H++OH-═H2O | |
| C. | 原混合溶液中 C(HCl):C(MgSO4)=3:1 | |
| D. | 从a→b→c说明溶液中结合OH-的能力强弱为:H+>Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:
草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:b<c | |
| B. | 最高价氧化物对应水化物的酸性:b>d | |
| C. | 单质沸点:d>c | |
| D. | a、b、c不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com