
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. lmol FeI2与足量氯气反应时转移的电子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 18gD2O和18gH2O中含有的质子数均为10NA
D. 1 mol Na2O2固体中含离子总数为4NA
科目:高中化学 来源: 题型:
【题目】
(Ⅰ)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g)![]() CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
(1)若增大H2O (g)的浓度,则CO的转化率 _________(填“增大”或“减小”)。
(2)若升高温度能使化学平衡向正反应方向移动,则正反应是____________(填“放热”或“吸热”)反应。
(Ⅱ)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a.C(s)+O2(g) ═ CO2(g);△H═ E1 ①
b.C(s)+H2O(g) ═ CO(g)+H2(g);△H═ E2 ②
H2(g)+1/2 O2(g) ═H2O(g);△H═ E3 ③
CO(g)+1/2 O2(g) ═CO2(g);△H═ E4 ④
请回答:
⑴与途径a相比,途径b有较多的优点,即____________。
⑵上述四个热化学方程式中哪个反应的△H>0 ?_____________。
⑶等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是(______)
A.a比b多 B.a比b少 C.a与b在理论上相同
⑷根据能量守恒定律,E1 、E2、 E3、E4之间的关系为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是 ( )
A. 可用氨水除去试管内壁上的银镜 B. 乙烯可以用作生产食品包装材料的原料
C. 食用白糖的主要成分是蔗糖 D. 乙酸与甲酸甲酯互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氧法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH____________(填“大于0”或“小于0”)。该反应在_______________条件下能自发进行(填“较高温度”、“较低温度”或“任何温度”)。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
(4)工业上,通常在乙苯蒸汽中掺混水蒸气(原料中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
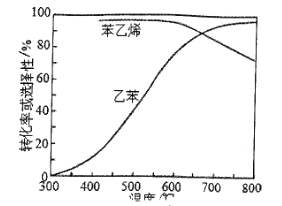
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实_________________________。
②控制反应温度为600℃的理由是_____________________。
(5)某燃料电池以乙苯为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,其负极的电极反应式为_____________________,正极上通入的气体为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。硫所在周期中,第一电离能最大的元素是___________。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________。
(3)H2S中S原子的杂化类型是__________;H2S的VSEPR模型名称为_________;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________个配位键,___________个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 向稀的苯酚水溶液中滴加饱和溴水,生成白色沉淀,产物三溴苯酚不溶于水
B. 植物油的主要成分是高级脂肪酸
C. 木材纤维和土豆淀粉遇碘水均显蓝色
D. 包装用材料聚乙烯和聚氯乙烯都属于烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )

A.1mol分枝酸最多可与3molNaOH发生中和反应
B.可与乙醇、乙酸反应,且反应类型相同
C.分子中含有2 种官能团
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色.且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com