

| A、0.5 mol?L-1 |
| B、0.1 mol?L-1 |
| C、1 mol?L-1 |
| D、1.5 mol?L-1 |
| 1×2×10 -3 |
| 2 |
| 10 -3mol |
| 0.01L |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| 第1份 | 第2份 | |
| 混合物质量(g) | 9.2 | 18.4 |
| 反应后固体质量(g) | 8.3 | 15.6 |
| A、本次实验至少要进行6次称重 |
| B、第1份混合物中NaOH的质量分数更大 |
| C、根据表中数据不能计算出第1份混合物中NaHCO3的质量分数 |
| D、第2份混合物中NaOH的质量分数小于0.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用0.10mol?L-1的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示,图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH,下列叙述不正确的是( )
实验室用0.10mol?L-1的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示,图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH,下列叙述不正确的是( )| A、此一元弱酸HA的电离平衡常数Ka≈1×10-4mol?L-1 |
| B、此弱酸的起始浓度约为1×10-2mol?L-1 |
| C、此实验最好选用酚酞试液(变色范围8.0~10.0)做指示剂 |
| D、当混合液pH=7时,溶液中c(HA)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
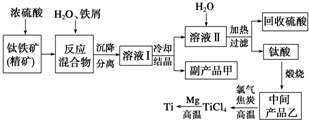 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如图:
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如图:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在蒸馏烧瓶中盛约
| ||
| B、收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 | ||
| C、冷水从冷凝管下口进,上口出 | ||
| D、将温度计水银球插到蒸馏烧瓶内的自来水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com