
| A. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| B. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| C. | 使用无铅汽油的汽车尾气不会污染空气 | |
| D. | 水体中植物营养物质过多积累会引起水体富营养化 |
分析 A.PM2.5是指空气中直径≤2.5μm的颗粒物;
B.铅离子为重金属离子,能够使蛋白质发生变性;
C.使用无铅汽油的汽车尾气依然可以产生氮的氧化物污染空气;
D.水中氮、磷元素的增多会引起水体的富营养化污染.
解答 解:A.PM2.5是指空气中直径≤2.5μm的颗粒物,不是指空气中氮氧化物和硫氧化物含量之和,故A错误;
B.鸡蛋清溶液中滴加醋酸铅溶液会发生变性,不是盐析,故B错误;
C.使用无铅汽油的汽车尾气可以降低铅离子污染,但仍然可以产生氮的氧化物等污染物,故C错误;
D.氮、磷元素,是植物的营养元素,水中氮、磷元素的增多会引起水体的富营养化污染,故D正确;
故选D.
点评 本题考查环境污染及治理,题目难度不大,明确常见环境污染类型、成因及治理措施为解答关键,试题有利于提高学生的环境保护意识.


科目:高中化学 来源: 题型:实验题
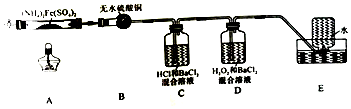
| 实验步骤 | 预期现象 | 结论 |
| 取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 若高锰酸钾溶液不褪色,加入KSCN溶液后变红 | 固体残留物仅为Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
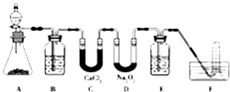 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
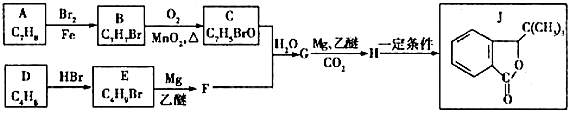
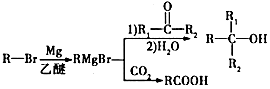
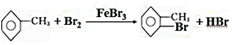 ,其反应类型为取代反应.
,其反应类型为取代反应.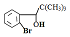 .
.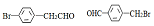 (写结构简式).
(写结构简式).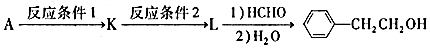
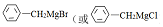 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
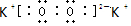 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com