
【题目】I.25℃时,往25mL氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:
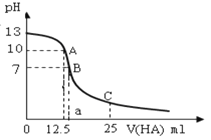
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)NaA的水溶液显______性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
【答案】0.1 1 ×10-4 碱 A-+H2O![]() HA+OH- c(Na+)=c(A-)>c(H+)=c(OH-) < > =
HA+OH- c(Na+)=c(A-)>c(H+)=c(OH-) < > =
【解析】
I.(1)由开始NaOH溶液的pH=13及水的离子积计算其浓度;
(2)根据物质的量关系可知,混合后溶液的溶质为NaA,图示信息得出,A点对应混合后的溶液pH = 10,则HA为弱酸,NaA存在水解平衡,由水电离出的氢氧根离子等于溶液中的氢氧根离子,据此分析作答;
(3)由图中a点分析等物质的量氢氧化钠与HA混合后溶液显碱性可推出,NaA存在水解平衡,据此分析判断;
(4)B点溶液显中性,c(H+) = c(OH),再结合电荷守恒规律作答;
Ⅱ.(1)根据表格可知,CH3COOH的Ka>HClO的Ka,则根据相同浓度的两种酸对水电离的抑制程度不同来分析作答;
(2)根据醋酸和次氯酸的电离平衡常数判断二者酸性强弱,酸性越强,对应的酸根离子的水解程度越弱,据此判断pH相同时醋酸钾和次氯酸钠的浓度大小;根据电荷守恒判断浓度关系。
I.(1)根据图示信息可知,开始NaOH溶液的pH=13,则c(H+) = 10-13 mol/L,根据 Kw = c(H+)×c(OH),则c(OH)=c(NaOH)=0.1 mol/L,
故答案为:0.1;
(2)由第(1)问可知,氢氧化钠的物质的量浓度为0.1 mol/L,a点时,c(NaOH)×V(NaOH) = c(HA)×V(HA),则溶液的溶质为NaA,根据图示信息可知,混合后溶液pH = 10,可推出HA为弱酸,A-水解显碱性,则溶液中的氢氧根离子浓度c(OH-) = ![]() =
= ![]() = 1 ×10-4 mol/L,则由水电离的氢氧根离子为1 ×10-4 mol/L,
= 1 ×10-4 mol/L,则由水电离的氢氧根离子为1 ×10-4 mol/L,
故答案为:1 ×10-4;
(3)a点溶质为NaA,其溶液pH = 10,则NaA存在水解平衡,其水溶液显碱性,发生的离子方程式为:A-+H2O![]() HA+OH-,
HA+OH-,
故答案为:碱;A-+H2O![]() HA+OH-;
HA+OH-;
(4)在B点所得混合溶液中,pH=7,则c(H+) = c(OH),又因为溶液中溶质为生成的NaA和过量的HA,遵循电荷守恒,故c(Na+)=c(A-)>c(H+)=c(OH-),
故答案为:c(Na+)=c(A-)>c(H+)=c(OH-);
Ⅱ.(1)因CH3COOH的Ka=1.8×10-5,HClO的Ka=3.0×10-8,则温度、浓度相同的CH3COOH和HClO溶液,CH3COOH的酸性大,即对水的电离抑制作用强,故水的电离程度前者小于后者,
故答案为:<;
(2)根据电离平衡常数可知:酸性CH3COOH>HClO,则NaClO的水解程度大于CH3COOK,所以pH相同时CH3COOK的浓度大于NaClO;由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:[c(Na+)-c(ClO-)] = [c(K+)-c(CH3COO-)],
故答案为:>;=。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】酯类化合物G是一种香料,以丙酮为初始原料合成该有机物的流程如下图所示(部分产物及反应条件已略去):
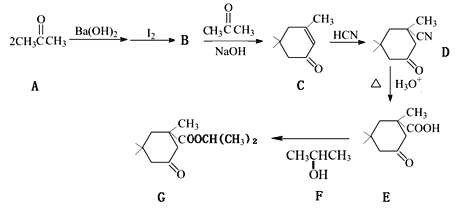
已知:![]()
(1)B的结构简式为______________,F的名称是__________。
(2)C中含氧官能团的名称是______________。
(3)C转化成D的反应类型_________________。
(4)D的分子式为_______________________。
(5)E转化成G的化学方程为________________。
(6)芳香化合物H比C少两个氢原子,能与氯化铁溶液反应显紫色且苯环上的一氯代物只有一种,写出满足上述条件的H的所有同分异构体的结构简式__________。H的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是____(填序号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)设计以CH3CH2CH2OH为起始原料制备2-甲基丙酸(![]() )的合成路线__(无机试剂任选)。
)的合成路线__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是

A. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
B. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+ B(g)![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.16 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.16 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号: X________、Y__________、Z____________、W、________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________,______________________。
(3)由X、Y、Z所形成的离子化合物是________________,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸二甲酯(DMF)俗称防霉保鲜剂霉克星1号,曾广泛应用于化妆品、蔬菜、水果等防霉、防腐、防虫、保鲜,它的一条合成路线如图所示。

回答下列问题:
(1)B的结构简式为______,D中官能团名称______。
(2)①的反应的类型是______,②的反应条件是______。
(3)④的反应方程式为______。
(4)写出C的一种同分异构体,满足可水解且生成两种产物可相互转化______。
(5)过程③由多个步骤组成,写出由C→D的合成路线_____。(其他试剂任选)(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是

A. 简单离子半径:Z<Y
B. d中既含有离子键又含有共价键, 其中阳离子和阴离子的数目之比为2:1
C. 简单气态氢化物的热稳定性:Y>X
D. 由上述4种元素组成的化合物的水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
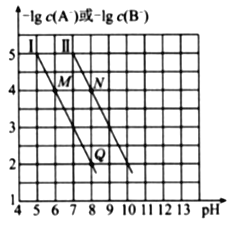
下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com