
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
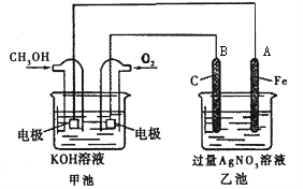
(1)放电时:正极参加反应气体22.4L(标准状况下),则转移电子的物质的量为___。
(2)在此过程中若完全反应,乙池中A极的质量增加216 g,则乙池中c(H+)=______(反应后溶液体积为2000mL)。
(3)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
【答案】4mol 1mol·L-1 CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol
【解析】
(1)放电时,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH-6e-+8OH-═![]() +6H2O,正极:O2+4e-+2H2O=4OH-;
+6H2O,正极:O2+4e-+2H2O=4OH-;
(2)乙池是电解池,总反应为:4Ag++2H2O![]() 4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,根据方程式计算氢离子的浓度。
4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,根据方程式计算氢离子的浓度。
(3)n(CH3OH)=![]() mol,结合燃烧热的概念书写热化学方程式。
mol,结合燃烧热的概念书写热化学方程式。
(1)放电时:正极:O2+4e-+2H2O=4OH-,正极参加反应气体22.4L(标准状况下),则转移电子的物质的量为![]() =4mol。故答案为:4mol;
=4mol。故答案为:4mol;
(2)电解总反应为:4Ag++2H2O![]() 4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,生成的氢离子的物质的量与银的物质的量相同,A极的质量增加216 g,则乙池中c(H+)=
4Ag↓+4H++O2↑,乙池中A极上银离子得电子发生还原反应,生成的氢离子的物质的量与银的物质的量相同,A极的质量增加216 g,则乙池中c(H+)=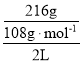 =1mol·L-1。故答案为:1mol·L-1;
=1mol·L-1。故答案为:1mol·L-1;
(3)n(CH3OH)=![]() mol,生成CO2和液态H2O时放热22.68kJ,则1molCH3OH燃烧生成CO2和液态H2O时放出的热量为22.68kJ×32=725.76kJ,表示甲醇燃烧热的热化学方程式为CH3OH(l)+
mol,生成CO2和液态H2O时放热22.68kJ,则1molCH3OH燃烧生成CO2和液态H2O时放出的热量为22.68kJ×32=725.76kJ,表示甲醇燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。
O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列检验某溶液中是否含有SO![]() 的方法中正确的是( )
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO![]()
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素及其化合物在生产生活中至关重要。
(1)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中含有的化学键包括____________________。
(2) NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是___________。
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有阴阳离子各一种,结构是正四面体型离子和正八面体型离子;正八面体型离子的化学式为_________________________;正四面体型离子中键角大于PCl3的键角原因为______________________________________________________。
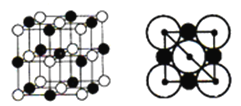
(4)氯化钠的晶胞结构如图所示,图是氯化钠的晶胞截面图(图中球大小代表半径大小)。已知NA代表阿伏加德罗常数的值,氯化钠晶体的密度为d g·cm-3。则Na+半径为____________pm(只需列出计算式)。
(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……
);……
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……
);……
①请在图中画出砷化硼晶胞的俯视图______。
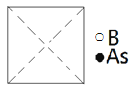
②砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )
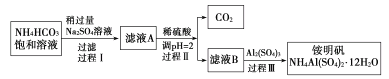
A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法不正确的是
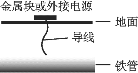
A.钢铁腐蚀时化学能不能全部转化为电能
B.钢铁腐蚀的负极反应式为Fe-2e-=Fe2+
C.如图所示,将导线与金属锌相连可保护地下铁管
D.如图所示,将导线与外接电源的正极相连可保护地下铁管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物K是治疗急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病药物的中间体,其合成路线如下,回答下列问题:
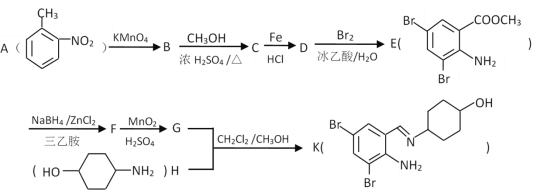
已知信息:
① 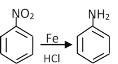
②![]()
③R1CHO+R2NH2 →R1CH=NR2
(1)B→C的反应类型为____________, H中官能团的名称为__________________。
(2)G的结构简式为______________,F→G的反应类型为_______________。
(3)D→E的反应方程式为___________________________________________。
(4)写出化合物D同时符合下列条件的同分异构体的结构简式_____________。
①苯环上有两个取代基,官能团与D相同,苯环上的一氯代物有两种
②核磁共振氢谱显示峰面积比为2:2:2:3
(5)已知:通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。写出以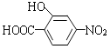 和
和![]() 为原料制备
为原料制备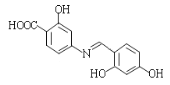 的合成路线______________________(其他试剂任选)。
的合成路线______________________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com