
【题目】实验题
(1)分别取Wg钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是。
(2)分别取0.1mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是。
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是。
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是。
【答案】
(1)![]() ∶
∶![]() ∶
∶![]()
(2)1∶2∶3
(3)23∶28∶9
(4)6∶3∶2
【解析】(1)Wg钠、铁、铝的物质的量分别为![]() mol、
mol、![]() mol、
mol、![]() mol,由钠、铁、铝与足量的盐酸反应的方程式:2Na+2HCl===2NaCl+H2↑;Fe+2HCl===FeCl2+H2↑;2Al+6HCl===2AlCl3+3H2↑;得2mol钠生成1mol氢气,1mol铁生成1mol氢气,2mol铝生成3mol氢气,故Wg钠、铁、铝生成氢气的体积比为
mol,由钠、铁、铝与足量的盐酸反应的方程式:2Na+2HCl===2NaCl+H2↑;Fe+2HCl===FeCl2+H2↑;2Al+6HCl===2AlCl3+3H2↑;得2mol钠生成1mol氢气,1mol铁生成1mol氢气,2mol铝生成3mol氢气,故Wg钠、铁、铝生成氢气的体积比为![]() mol∶
mol∶![]() mol∶
mol∶![]() mol=
mol=![]() ∶
∶![]() ∶
∶![]() ;同理可解得到(2)、(3)、(4)的答案。
;同理可解得到(2)、(3)、(4)的答案。
【考点精析】掌握钠的化学性质是解答本题的根本,需要知道钠的化学性质:与非金属反应;与水反应;与酸反应;与盐溶液反应.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】“人类只有一个地球!”,为了保护人类赖以生存的环境,下列做法中不正确的是( )
A. 回收处理垃圾,变废为宝
B. 废旧电池中含有Hg2+等重金属离子,会污染地下水与土壤,必须回收处理
C. 为了牟取利益,捕杀、贩卖野生动物
D. 开发新能源,逐步减少使用化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ABCDE五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题: 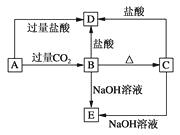
(1)写出化学式:A , B , C , D , E。
(2)写出下列反应的离子方程式: A→B: ,
B→D: ,
C→E:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
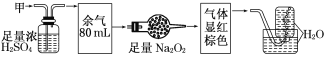
A.NH3、NO、CO2 B.NH3、NO2、N2 C.NH3、NO2、CO2 D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是( )
A.利用二氧化硅与碳酸钙常温反应制备陶瓷
B.纺织业利用氢氧化钠的强氧化性将其作为漂洗的洗涤剂
C.利用明矾的水溶液除去铜器上的铜锈,因Al3+水解呈酸性
D.“丹砂(主要成分为硫化汞)烧之成水银,积变又还成丹砂”中发生的反应为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为1 L的密闭容器中加入一定量的X、Y,发生反应aX(g)+2Y(s)![]() bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。

根据以上信息,下列说法正确的是 ( )。
A. 用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol·L-1·min-1
B. 根据上图可求得化学方程式中a∶b=1∶3
C. 推测在第7 min时曲线变化的原因可能是升温
D. 推测在第13 min时曲线变化的原因可能是降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量的说法正确的是
A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,E反应物>E生成物
B.CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.5 kJ·mol-1,E反应物>E生成物
C.HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(s) ΔH=-13.25 kJ·mol-1,由此可知将1 mol HI通入密闭容器中反应可以放出13.25 kJ热量
I2(s) ΔH=-13.25 kJ·mol-1,由此可知将1 mol HI通入密闭容器中反应可以放出13.25 kJ热量
D.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓H2SO4溶液混合后放热57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述,其因果关系成立的是
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH
D.因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com