
【题目】向25℃时,体积均为20mL、浓度均为0. 1mol·L-1的两种酸HX、HY溶液中分別滴加0. 1mol·L-1的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
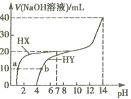
A. HX与NaOH溶液反应的离子方程式为:HX +OH-=X-+H2O
B. Ka(HY)的数量级约为10-10
C. b点时: c(Na+)=c(Y-)+c(HY)
D. V(NaOH)= 20mL时,两种反应后的溶液中c(X-)>c(Y-)
【答案】D
【解析】分析:浓度均为0.1molL-1的两种酸HX、HY,由图可知,HX的pH等于1,HY的pH等于4,则HX为强酸,HY为弱酸,然后根据盐类水解的规律结合溶液的pH分析解答。
详解:A.由图可知,HX为强酸,所以HX与NaOH溶液发生反应的离子方程式为H++OH-=H2O,故A错误;B.浓度为0.1molL-1的HY,由图可知,HY的pH等于4,则Ka(HY)=![]() =
=![]() =10-7,故B错误;C. b点溶液中存在等浓度的HY和NaY,根据物料守恒,2c(Na+)=c(Y-)+c(HY),故C错误;D. V(NaOH)= 20mL时,两个反应均恰好完全进行,生成盐溶液,由于Y-发生水解,因此反应后的溶液中c(X-)>c(Y-),故D正确;故选D。
=10-7,故B错误;C. b点溶液中存在等浓度的HY和NaY,根据物料守恒,2c(Na+)=c(Y-)+c(HY),故C错误;D. V(NaOH)= 20mL时,两个反应均恰好完全进行,生成盐溶液,由于Y-发生水解,因此反应后的溶液中c(X-)>c(Y-),故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Mg2+、Cl﹣、SO42﹣
B.滴加石蕊试液显红色的溶液::K+、Al3+、Cl﹣、NO3﹣
C.含有0.1molL﹣1Ca2+的溶液中:Na+、K+、CO32﹣、Cl﹣
D.无色透明的酸性溶液中:MnO4﹣、K+、SO42﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
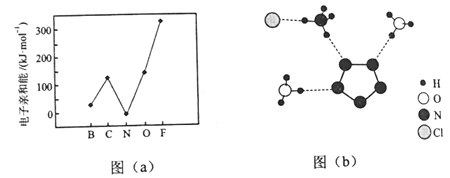
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当溶液中XO42- 和SO32-的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )
A.+1
B.+2
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________________________________________________ (用必要的化学用语和相关文字说明)。
(2)相同温度下,浓度均为0.1 mol/L 的下列溶液中的c(![]() )由大到小_____(填序号)。
)由大到小_____(填序号)。
①NH4Al(SO4)2 ②CH3COONH4 ③ NH4HSO4 ④NH3·H2O ⑤NH4Cl
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图像。其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是_____(填写字母)。
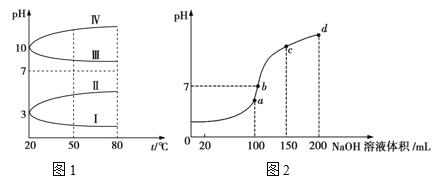
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____;在b点,溶液中各离子浓度由大到小的排列顺序是______;在cd段发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀溶解平衡在生产、科研和环保等领域有着许多应用。
(1)除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入Cu(OH)2,调节溶液的PH,铁离子就会全部转化为Fe(OH)3沉淀除去。
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小等于1×10-5molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL-1,通过计算确定应调节溶液的pH范围是______。(已知lg5=0.7)
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol·L-1 AgNO3溶液 | 现象a,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变为红色的离子方程式:____________________。
②步骤3中现象a是____________________________。
③用化学平衡原理解释步骤4中的实验现象:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
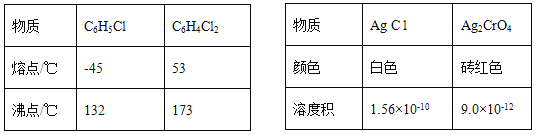
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
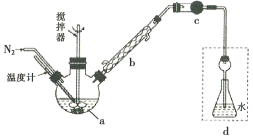
回答下列问题:
(1)仪器a的名称是________,搅拌器的作用是_______。
(2)反应结束后,还要继续通入N2的目的是__________;仪器c盛装的试剂是________(填序号)。
A.碱石灰 B.浓硫酸 C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯:_____________
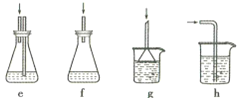
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_________(填序号)。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为______;若消耗22.50mL AgNO3溶液,则无水FeCl3的转化率为_____。
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏_______(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH=7的溶液一定显中性
B. pH=6的溶液一定显酸性
C. c(H+)<c(OH-)的溶液一定显碱性
D. c(OH-)=1×10-6mol/L的溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、T五种元素,X原子的M层p轨道有2个未成对电子,Y原子的外围电子构型为3d64s2,Z原子的L电子层的p能级上有一空轨道,Q原子的L电子层的p能级上只有1对成对电子,T原子的M电子层上p轨道半充满。试写出:
(1)X的元素符号__________,Y的元素符号__________。
(2)Z的电子排布式__________,Q的电子排布图__________,T的电子排布图__________。
(3)Y的单质在Q的单质中燃烧的化学方程式__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com