
| A. | 使用催化剂能加快反应 | B. | 升高温度能增大反应的速率 | ||
| C. | 改变压强对反应速率没有影响 | D. | 降低温度能加快反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++HCO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 | |
| B. | 用灼烧的方法可以区别人造丝和蚕丝,因为蚕丝是蛋白质,被灼热时会产生具有烧焦羽毛的气味 | |
| C. | 食品添加剂虽然能改善食物的色、香、味,但由于他们对健康有害,均不宜食用 | |
| D. | 高温消毒是通过加热的方法使细菌的蛋白质变性而死亡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是金属元素 | B. | 原子半径相差不大 | ||
| C. | 最外层电子数相同 | D. | 化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
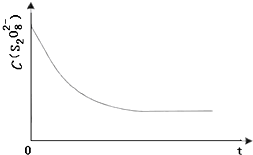 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:| 实验序号 | 体积/mL溶液 | ||||
| K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | V1 | V3 | 4.0 | 2.0 |
| ③ | 8.0 | V2 | V4 | V5 | 2.0 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:实验题
某 校化学研究性学习小组查阅资料了解到以下内容:
校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______________.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去 ,请配平该反应的离子方程式:
,请配平该反应的离子方程式:
______MnO4﹣+______ H2C2O4+______ H+═______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
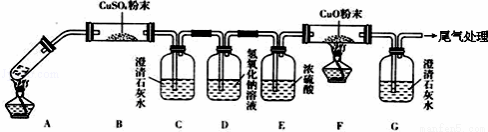
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红 色.据此回答:
色.据此回答:
上述装置中,D的作用是_________.乙二酸分解的化学方程式为_________.只根据G中澄清石灰水变浑浊能否得出“草酸分解产物中一定有CO”的结论_________(填“ 能或不能”)
能或不能”) 若不能应怎样改进?______________.
若不能应怎样改进?______________.
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是_________
A.c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)
B.c(HC2O4﹣)+c(C2O42﹣)=0.2mol•L ﹣1
﹣1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D.c(Na+)=c(H2C2 O4)+c(HC2O4﹣)+c(C2O42﹣)
O4)+c(HC2O4﹣)+c(C2O42﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com